Selamat Datang kembali di blog freemathlearn. Blog yang membahas seputar matematika dan ilmu sains lainnya. Baiklah untuk kali ini akan kita bahas mengenai
Soal Pilihan Ganda Perubahan Entalpi Reaksi. Silakan disimak ya guys!
>
Nah itulah tadi telah diuraikan mengenai Soal Pilihan Ganda Perubahan Entalpi Reaksi. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
>
Kompetensi Dasar
- Menentukan reaksi berdasarkan percobaan, hukum Hess, data perubahan entalpi pembentukan standar, dan data energi ikatan.
Indikator
- Menghitung harga ∆H reaksi melalui percobaan.
- Menghitung harga ∆H reaksi dengan menggunakan: data entalpi pembentukkan standar, diagram siklus, energi ikatan.
Pilihlah Jawaban Yang Benar
Soal 1
A. - 92
B. - 46
C. + 46
D. + 92
E. + 138
Soal 2
Diketahui perubahan entalpi sebagai berikut :
Perubahan entalpi pada pembentukan gas metana sebesar . . . .kJ/mol
A. - 393,5
B. - 75,1
C. + 75,1
D. + 285,5
E. +393,5
Soal 3
Diekatahui reaksi :
A. + 450
B. + 225
C - 225
D. - 300
E. - 450
Soal 4
Diketahui persamaan rekasi kimia berikut ini.
A. (a + b)
B. (2a + b)
C. (2a - b)
D. (b - 2a)
E. (2b + a)
Soal 5
A. 63,0
B. 30,0
C. 25,2
D. 18,9
E. 12,6
Soal 6
Diberikan dua rekasi pembakaran berikut .
A. - 2.520
B. - 1.520
C. - 840
D. + 840
E. + 2.520
Soal 7
Air sebanyak 2 Liter dipanaskan dengan pembakaran elpiji dari suhu  menjadi
menjadi  . Elpiji dianggap mengandung
. Elpiji dianggap mengandung 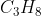 (Mr = 44) dan yang terbakar sebanyak 44 gram. Seluruh energi yang terbakar digunakan untuk menaikkan suhu air. Jika diketahu massa jenis air =
(Mr = 44) dan yang terbakar sebanyak 44 gram. Seluruh energi yang terbakar digunakan untuk menaikkan suhu air. Jika diketahu massa jenis air = , dan kalor jenis air =
, dan kalor jenis air =  , besarnya perubahan entalpi rekasi pembakaran elpiji . . . . .kJ/mol
, besarnya perubahan entalpi rekasi pembakaran elpiji . . . . .kJ/mol
A. - 403,2
B. - 4,18
C. 4,18
D. 403,2
E. 420
Loading...
Soal 8
Diketahui data persamaan termokimia berikut!
A. - 856
B. - 984
C. - 1.161
D. - 1,904
E. - 1.966
Soal 9
A. - 284,3
B. - 110,9
C. +110,9
D. + 284,3
E. + 679,5
Soal 10
Kalor pembakaran propana sebesar - 2.220 kj/mol
Energi panas yang dihailkan ketika 11 gram karbondioksida dihasilkan dari pembakaran sempurna propana adalah . . . . .kJ
A. 1/4 x 1/3 x (-2.220)
B. 4 x 3 x (-2.220)
C. 1/3 x (-2.220)
D. 1/4 x (-2.220)
E. 3/4 x (-2.220)
Soal 11
Perhatikan diagram berikut!
Harga yaitu . . . kJ
A. 180
B. 147
C. 123
D. - 123
E. - 147
Soal 12
Perhatikan persamaan rekasi kimia berikut!
Berdasarkan reaksi diatas, grafik yang menunjukkan proses reksi tersebut adalah . . . . .
Soal 13
Diketahui energi ikatan rata - rata :
C = C = 607 kJ/mol
C - C = 343 kJ/mol
C - H = 410 kJ/mol
O - H = 460 kJ/mol
C - O = 351 kJ/mol
Perubahan entalpi pada reaksi :
Sebesar . . . . kJ/mol
A. - 111
B. - 74
C. - 37
D. +37
E. + 111
Soal 14
A. - 140,6
B. - 95,4
C. + 95,4
D. + 140,6
E. + 361
Soal 15
Persamaan rekasi untuk pembakaran etanol dengan oksigen berlebih ditunjukkan dibawah ini.
Diagram tingkat energi yang menunjukkan rekasi di atas adalah . . . . .
.
Nah itulah tadi telah diuraikan mengenai Soal Pilihan Ganda Perubahan Entalpi Reaksi. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
Loading...










