Selamat Datang kembali di blog freemathlearn. Blog yang membahas seputar matematika dan ilmu sains lainnya. Baiklah untuk kali ini akan kita bahas mengenai
Soal Ujian Akhir Semester Ganjil Kelas XI. Silakan disimak ya guys!
>
![\frac{5}{1,25} = \frac{[0,2]^{x}}{[0,1]^{x}}](https://latex.codecogs.com/gif.latex?\frac{5}{1,25}&space;=&space;\frac{[0,2]^{x}}{[0,1]^{x}})

Mencari harga y ==> cari [Q ] yang sama yaitu kondisi 1 dan 3
![\frac{V3}{V1} = \frac{[0,1]^{x}[0,2]^{y}}{[0,1]^{x}[0,1]^{x}}](https://latex.codecogs.com/gif.latex?\frac{V3}{V1}&space;=&space;\frac{[0,1]^{x}[0,2]^{y}}{[0,1]^{x}[0,1]^{x}})
![\frac{10}{1,25} = \frac{[0,2]^{y}}{[0,1]^{x}}](https://latex.codecogs.com/gif.latex?\frac{10}{1,25}&space;=&space;\frac{[0,2]^{y}}{[0,1]^{x}})

Jadi persamaan laju rekasinya menjadi :
![V = k [Q]^{2}[Y]^{3}](https://latex.codecogs.com/gif.latex?V&space;=&space;k&space;[Q]^{2}[Y]^{3})
Nah belum selesai, kita cari harga k nya dulu dengan cara memakai salah satu kondisi. Saya pakai yang pertama saja.
![V = k [Q]^{2}[Y]^{3}](https://latex.codecogs.com/gif.latex?V&space;=&space;k&space;[Q]^{2}[Y]^{3})
![k = \frac{v}{[Q]^{2}[Y]^{3}}](https://latex.codecogs.com/gif.latex?k&space;=&space;\frac{v}{[Q]^{2}[Y]^{3}})
![k = \frac{1,25x10^{-2}}{[0,1]^{2}[0,1]^{3}}](https://latex.codecogs.com/gif.latex?k&space;=&space;\frac{1,25x10^{-2}}{[0,1]^{2}[0,1]^{3}})


Jika [P] = [Q] = 0,5 M
![V = k [Q]^{2}[Y]^{3}](https://latex.codecogs.com/gif.latex?V&space;=&space;k&space;[Q]^{2}[Y]^{3})
V = 1250 (0,5)^2 (0,5)^3
= 1250 x 125 x 10^-5
= 1,5625 M/s
Soal 14
Diketahui pembakaran gas asetilen menurut reaksi :
2C2H2(g) + 5O2(g) ==> 4CO2(g) + 2H2O(l) = -2.599 kJ/mol
= -2.599 kJ/mol
Pada reaksi tersebut untuk pembakaran 10 L gas C2H2 pada keadaan standar STP melepas kalor sebanyak . . . .
Pembahasan
Nah jika kita perhatikan reaksi :
2C2H2(g) + 5O2(g) ==> 4CO2(g) + 2H2O(l) = -2.599 kJ/mol
= -2.599 kJ/mol
 reaksi yang dihasilkan pada reaksi diatas adalah untuk pembakaran 2 mol gas C2H2 (lihat koefisien rekasi C2H2 yang 2 mol)
reaksi yang dihasilkan pada reaksi diatas adalah untuk pembakaran 2 mol gas C2H2 (lihat koefisien rekasi C2H2 yang 2 mol)
Untuk itu kita ubah menjadi reaksi untuk pembakaran 1 mol gas C2H2 dengan membagi semua koefisien reaksi zat dengan 2 termasuk harga
reaksi untuk pembakaran 1 mol gas C2H2 dengan membagi semua koefisien reaksi zat dengan 2 termasuk harga  nya. Jadi nya seperti ini :
nya. Jadi nya seperti ini :
C2H2(g) + 5/2O2(g) ==> 2CO2(g) + H2O(l) = - 1299,5 kJ/mol
= - 1299,5 kJ/mol
Untuk pembakaran 10 L gas C2H2, karena suhunya adalah 25 (25 + 273 = 298 K) derajat Celsius maka untuk mencari mol kita gunakan persamaan gas ideal yaitu :
n = P.V/R.T
= 1 atm . 10 L / 0,082 L atm mol -1 K -1 . 298 K
= 10/24,436 mol
= 0,409 mol
mol C2H2 = P.V/R T
 reaksi = n x
reaksi = n x  1 mol C2H2
1 mol C2H2
= 0,409 mol x - 1299,5 kJ/mol
= 531,8 kJ
Soal 15
Diketahui energi ikatan rata rata :
C C : 839 kJ/mol
C : 839 kJ/mol
C - C : 343 kJ/mol
H - H : 436 kJ/mol
C - H : 410 kJ/mol
Perubahan entalpi yang terjadi pada reaksi berikut :
CH3 - C CH + 2H2 ==> CH3 - CH2 - CH3 adalah sebesar . . . .?
CH + 2H2 ==> CH3 - CH2 - CH3 adalah sebesar . . . .?
Pembahasan
Ini adalah konsep menghitung harga perubahan entalpi menggunakan data energi ikatan. Kalian harus buat jenis ikatan yang terdapat pada masing masing senyawa pada reaksi diatas untuk mengetahui jumlah ikatn tunggal maupun rangkap. Saya tidak buat gambar jenis ikatannya, tapi akan saya jabarkan saja.
Reaktan
Senyawa : CH3 - C CH, terdiri dari 4 buah ikatan C - H, 1 buah ikatan C - C dan 1 buah ikatan C
CH, terdiri dari 4 buah ikatan C - H, 1 buah ikatan C - C dan 1 buah ikatan C  C.
C.
Senyawa 2 H2, dalam sebuah senyawa terdapat 1 buah ikatan H - H. Karena senyawanya ada 2, maka terdapat 2 buah ikatan H - H
Produk
Senyawa : CH3 - CH2 - CH3, terdapat 8 buah ikatan C - H dan 2 buah ikatan C - C.
Jika ada ikatan yang sama maka kita kurangkan dari yang banyak. Misalnya
Direaktan ada 4 ikatan C - H, sedangkan produk ada 8 buah ikatan C - H. Maka jika kita coret karena enerinya sama, maka akan bersisa di produk sebanyak 4 buah sedangkan direaktan sudah tidak ada. Begitu seterusnya jadi di reaktan ikatan C - C nya habis dan diproduk sisa 1.
Energi pemutusan ikatan reaktan
= 1 x C C + 2. H - H = 1 x 839 + 2 x 436 = 1711 kJ/mol
C + 2. H - H = 1 x 839 + 2 x 436 = 1711 kJ/mol
Energi pemutusan ikatan produk
= (4. C H + 1 . C - C) = (4. 410 + 1. 343 ) = 1983 kJ/mol
 reaksi = Energi pemutusan reaktan - energi pemutusan produk
reaksi = Energi pemutusan reaktan - energi pemutusan produk
= 1711 - 1983
= - 272 kJ/mol
Soal 16
Perhatikan gambar diagram entalpi berikut
Berdasarkan diagram entalpi tersebut jenis reaksi dan alasan yang tepat adalah?
Pembahasan :
Nah pada soal ini kita diminta membaca gamabar kemudian menuliskan kesimpulan. Soal ini mudah sebenarnya apalagi sudah diketahui harga reaksinya.
reaksinya.
Karena reaksinya bernilai negatif maka reaksi ini tergolong ekdoter. Pada diagram diatas reaktan memiliki entalpi yang lebih tinggi dari produk ( H rekatan > H produk) sehingga harga perubahan entalpi (
reaksinya bernilai negatif maka reaksi ini tergolong ekdoter. Pada diagram diatas reaktan memiliki entalpi yang lebih tinggi dari produk ( H rekatan > H produk) sehingga harga perubahan entalpi ( = H produk - H reaktan) akan bernilai negatif.
= H produk - H reaktan) akan bernilai negatif.
Soal 17
Perhatikanlah gambar bentuk molekul dibawah ini.
Bentuk molekul tersebut dimiliki oleh senyawa . . . . (Nomor atom H = 1, O = 8, P =15, Cl = 17, F = 19, Te = 52 dan Xe = 54)
A. H2O
B. PCl5
C. ClF3
D. TeCl4
E. XeF2
Pembahasan :
Perhatikanlah bentuk molekulnya dengan seksama. Atom pusatnya ada ditengah dan memiliki 4 buah ikatan dengan atom lain dan satu buah pasangan elektron bebas. Pastinya jumlah atom penusun dalam senyawa tersebut adalah 5 yaitu 1 buah atom pusat dan 4 buah atom cabang.
Dari penalaran diatas kita bis tarik kesimpulan bahwa jawabannya pasti TeCl4 karena hanya senyawa ini yang mempunyai 5 buah atom penyusun molekulnya. Dengan cara ini sebenarnya kalian tidak perlu terlalu hafal tabel bentuk molekul senyawa yang cukup banyak itu. Tapi tentu jika hafal akan lebih baik bukan. Karena ini untuk persiapan ujian jadi saya kasih cara singkat saja.
Untuk memastikannya, marilah kita cari bentuk molekul dari senyawa TeCl4.
Atom pusat = Te , Konfigurasi = 2 8 18 18 6, ev = 6
Atom Cabang = 4 Cl, Konfigurasi = 2 8 7, ev = 7
Untuk mencari jumlah elektron bebas kita bisa pakai rumus beriku:
E = (ev Atom pusat - pei)/2 = (6 - 4)/2 = 1
Nah dapat dibuktikan bahwa gambar molekul pada soal diatas adalah bentuk molekul dari senyawa TeCl4 dengan 4 buah pasangan elektron ikatan dan 1 buah pasangan elektron bebas.
Soal 18
JIka nomor atom C = 6 dan nomor atom H = 1, bentuk molekul dari CH4 adalah . . . .?
Pembahasan :
Kita gunakan konsep teori domain elektron untuk menentukan bentuk molekulnya. Syaratnya ya kalian harus hafal tipe molekul berdasarkan teori ini.
Pertama buat konsfigurasi dulu untuk menentukan jenis ikatan kovalen antara C dan H. Kalian pasti sudah tahu jenisnya kan.
6 C = 2 4 , ev = 4 ==> Atom Pusat
1 H = 1 , ev = 1 ==> Atom Cabang
Atom H hanya butuh sebuah elektron lagi agar duplet, sehingga dia akan berikatan tunggal dengan atom C.
Berarti jumlah pasangan elektron ikatannya = X = 4
Kemudian kita tentukan pasangan elektron bebasnya.
PEB = E = (ev Atom pusat - pei)/2 = (4 - 4)/2 = 0
Jadi pada molekul CH4 terdapat 4 buah PEI dan 0 buah PEB, sehingga tipe molekulnya adalah AX4. Bentuk molekul dengan tipe ini adalah tetrahedral.
Soal 19
Diketahui rumus senyawa dan orbital hibridanya sebagai berikut.
No Rumus Senyawa Orbital hibrida
1 CCl4 sp3
2 SbCl5 sp3d3
3 BCl3 sp
4 H2S sp3
(nomor atom C= 6, Cl = 17, Sb = 51, B = 5 dan S = 16)
Pasangan rumus senyawa dengan orbital hibridanya yang tepat ditunjukkan oleh nomor. . . .?
Pembahasan
Saya contohkan satu buah saja cara mencarinya dan kalian pasti akan bisa membuat untuk senyawa lain.
Senyawa CCl4
Yang kita perhatikan adalah elektron valensi atom pusat dan atom cabang.
6 C = 1s2 2s2 2p2, ev = 4
17 Cl = 1s2 2s2 2p6 3s2 3p5 , ev = 7
4 buah atom Cl pada senyawa CCl4 hanya membutuhkan satu buah elektron lagi dari atom pusat C, jadi atom C total harus menyediakan 4 buah elektron menyendiri untuk dipasangkan dengan Cl.
Diagram orbital C
Jadi nomor satu cocok bahwa orbital hibrida untuk CCl4 adalah sp3. Silahkan lanjutkan dengan cara yang sama untuk senyawa lainnya. Pasti akalian akan temukan jawabannya.
Soal 20
Diketahui harga keelektronegatifan Br = 2, 7 dan Cl = 2,8. Gaya antar molekul yang terjadi pada senyawa BrCl berupa . . . . .
A. Ikatan ion
B. Gaya london
C. ikatan hidrogen
D. gaya dipol sesaat
E. gaya tarik dipol
Pembahasan :
Untuk mengetahuai jenis gaya antar molekul yang terjadi antara senyawa BrCl maka kita harus identifikasi dulu apakah senyawa polar atau non polar.
Senyawa polar adalah senyawa yang perbedaan keelektronegatifannya kecil atau bahakan 0. Jika kita hitung selisih keelektronegatifan antara Br dan Cl dalam senyawa BrCl hanya 0,1 yaitu tergolong kecil. Sehingga dapat kita simpulkan bahwa senyawa BrCl adalah senyawa nonpolar.
Interaksi atau gaya antrar molekul yang terjadi antara dua molekul nonpolar disebut gaya london.
Ikatan ion = ikatan antar atom dalam molekul
Ikatan hidrogen = ikatan antara atom H dengan atom yang sangat elektronegatif. Jadi senyawanya harus mempunyai atom. Ikatan ini paling banyak terjadi dalam molekul NH3, H2O dan HF.
Soal 21
Diberikan beberapa senyawa sebagau berikut:
1. HF 4. HCl
2. NH3 5. CH4
3. H2O
Berdasarkan informasi diatas. senyawa senyawa yang mengandung ikatan hidrogen adalah senyawa denga nomor. . . . .
Pembahasan.
Seperti yang dijelaskan pada pembahasan sola sebelumnya bahwa ikatan hidrogen terjadi pada senyawa HF, NH3 dan H2O (1,2 dan 3). Hal ini disebabkan karena selisih keelektronegatifan dalam ketiga atom (F, N dan O) dengan unsur H sangat besar karena ketiga atom tersebut memiliki harga keelektrongatifan paling besar dalam sistem periodik.
Soal 22
Diketahui persamaan reaksi termokimia sebagai berikut:
1). C(s) + O2(g) ==> CO2(g) = - 394 kJ/mol
= - 394 kJ/mol
2.) H2(g) + 1/2O2(g) ==> H2O(g) = - 296 kJ/mol
= - 296 kJ/mol
3.) 6C(s) + 3H2(g) ==> C6H6(g) = - 83 kJ/mol
= - 83 kJ/mol
Berdasarkan reajsi tersebut perubahan entalpi pembakaran untuk C6H6 adalah . . . .?
Pembahasan
Ini adalah salah satu contoh soal menentukan perubahan entalpi dengan hukum Hess. Nah yang agak menantang disini adalah kita tidak diberikan reaksi yang akan kita cari perubahan entalpinya, sehingga menuntut kemahiran kita dalam membuat reaksinya.
Reaksi yang ditanya adalah reaksi pembakaran C6H6. Senyawa C6H6 adalah senyawa hidrokarbon yang apabila dibakar (direaksikan denan O2) akan menghasilkan CO2 dan H2O. Kemudian tinggal kita setarakan rekasinya.
Reaksi setaranya :
2C6H6(g) + 15O2(g) ==> 12CO2(g) + 6H2O(g)
Kita harus susun reaksi diatas sehinngga jika kita jumlahkan hasilnya adalah reaksi pembajaran C6H6.
Kita mulai dari C6H6. Reaksi yang diketahui memiliki C6H6 adalah reaksi ke-3, tetapi letaknya diproduk sementara untuk rekasi yang diminta adalah direaktan, maka rekasi tersebut dibalik. nya berubah tanda dari - ke + .
nya berubah tanda dari - ke + .
C6H6 ==> 6C + 3H2 = + 83 kJ/mol
= + 83 kJ/mol
Kemudian C6H6 yang dibutuhkan pada reaksi yang diminta adalah 2 mol, maka koefisien reaksi yang telah dibalik diatas kita kali 2, termasuk harga nya.
nya.
(1) 2C6H6 ==> 12C + 6H2 = + 166 kJ/mol
= + 166 kJ/mol
Langkah selanjutnya adalah mencari dari reaksi yang diketahui ada CO2 yaitu reaksi 1. Pada reaksi yang diminta cari perubahan entalpinya CO2 berada diproduk dan pada reaksi 1 posisi CO2 sudah ada di produk sehingga tidk usah kita ubah. CO2 yang ada pada reaksi yang diminta ada 12 mol, sehingga koefisien reaksi 1 harus dikali 12 dan juga harga nya.
nya.
(2) 12C(s) + 12O2(g) ==> 12CO2(g) = - 4728 kJ/mol
= - 4728 kJ/mol
Tinggal reaksi ke 2 yang belum disesuaikan dengan reaksi yang diminta. Kita sesuaikan dengan posisi H2O nya. Pada reaksi yang diminta dan rekasi 2 yang diketahui posisi H2O sudah sama sam berada di produk hanya molnya saja yang harus diubah. Pada reaksi yang diminta ada 6 mol H2O sehingga koefisien reaksi 2 harus dikali 6 termasuk harga nya.
nya.
(3) 6H2(g) + 3O2(g) ==> 6H2O(g) = - 1776 kJ/mol
= - 1776 kJ/mol
Langkah terakhir tinggal jumlahkan rekasi rekasi yang telah kita ubah yang hasilnya pasti sesuia dengan reaksi yang diminta dan jumlahkan juga harga nya maka itulah harga perubahan entalpi pembakaran C6H6.
nya maka itulah harga perubahan entalpi pembakaran C6H6.
2C6H6 ==>12C + 6H2  = + 166 kJ/mol
= + 166 kJ/mol
12C(s) + 12O2(g) ==> 12CO2(g)  = - 4728 kJ/mol
= - 4728 kJ/mol
6H2(g) + 3O2(g) ==> 6H2O(g)  = - 1716 kJ/mol +
= - 1716 kJ/mol +
2C6H6(g) + 15O2(g) ==> 12CO2(g) + 6H2O(g) = - 6278 kJ
= - 6278 kJ
Karena yang diminta adalah untuk kJ/mol, maka harga reaksi diatas tinggal dibagi 2 termasuk koefisiennya. Hasil
reaksi diatas tinggal dibagi 2 termasuk koefisiennya. Hasil  adalah - 3139 kJ/mol.
adalah - 3139 kJ/mol.
Soal 23
Sebanyak 22,8 gram bahan bakar yang tidak dikenal (Mr = 114) dibakar sempurna. Panas yang dihasilkan dapat menaikkan suhu 100 mL air sebesar 10 derajat Celsius. Jika massa jenias air 1 g/mL dan cp air = 4,2 J/gr K, kaor pembakaran dari bahan bakar tersebut sebesar . . . .?
Pembahasan :
Ini adalah soal menghitung perubahan entalpi reaksi memalui percobaan kalorimeter.
massa larutan = 100 mL x 1 gr/mL = 100 gram
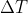 = 10 derajat Celsius = 10 + 273 = 283 K
= 10 derajat Celsius = 10 + 273 = 283 K
Kalor yang dilepas oleh reaksi pembakaran gas tak dikenal tersebut
= - q larutan
= - ( m c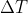 )
)
= - (100 gram . 4,2 J/gr K . 10)
= - 4200 J
= - 4,2 kJ
Untuk 22,8 gram bahan bakar akan dihasilkan kalor sebanyak =
mol = gr/Mr = 22,8/114 = 0,2 mol
 = 1/0,2 x - 4,2 kJ
= 1/0,2 x - 4,2 kJ
= - 21,00 kJ
Soal 24
Diketahui kalor pembentukan standar ( 0f) MgO(s) dan CO2(s) berturut turut adalah - 600 kJ/mol dan - 359 kJ/mol. Besar perubahan entalpi untuk reaksi :
0f) MgO(s) dan CO2(s) berturut turut adalah - 600 kJ/mol dan - 359 kJ/mol. Besar perubahan entalpi untuk reaksi :
2MgO(s) + C(s) ==> 2Mg(s) + CO2(g) adalah . . . .kJ.
Pembahasan :
Jika kalian bisa memahami soal, ini adalah soal mencari harga perubahan entalpi menggunakan konsep huku Hess. Namun sulitnya adalah kita tidak diberi rekasi yang diketahui. Jadi ya terpaksa kita harus tulis reaksi itu.
Yang diketahui disoal kan kalor pembentukan standar MgO dan CO2, artinya zat tersebut akan dibuat sebanyak 1 mol dari unsur unsurnya. MgO terbuat dari Mg(s) dan O2(g) sedangkan CO2 terbuat dari C(s) dan O2(g), tinggal tulis reaksinya dan setarakan. Tapi ingat jangan pernah mengubah koefisien zat yang dibentuk karena yang diketahu kan kalor pada keadaan standar yaitu 1 mol zat.
Reaksi yang diketahui berdasarkan soal :
1. Mg(s) + 1/2O2(g) ==> MgO(s) = - 600 kJ/mol
= - 600 kJ/mol
2. C(s) + O2(g) ==> CO2(g) = - 359 kJ/mol
= - 359 kJ/mol
Reaksi yang diminta :
2MgO(s) + C(s) ==> 2Mg(s) + CO2(g)
Langkah pertama adalah mencari reaksi yang diketahui mengandung MgO yaitu rekasi pertama tetapi pada reaksi itu letak MgO nya diproduk sementara pada reaksi yang diminta ada dikanan. Reaksinya harus kita balik. Kemudian pada reaksi yang diminta koefisien reaksinya adalah 2, maka setelah dibalik semua koefisien reaksi pertama dikali 2 termasuk harga perubahan entalpinya.
Jadinya begini :
3. 2MgO(s) ==> 2Mg(s) + O2(g) = + 1200 kJ/mol
= + 1200 kJ/mol
Langkah kedua adalah menyesuaikan reaksi ke-2 agar ketika dijumlahkan dengan reaksi 3 jadinya adalah reaksi yang diminta. Dari reaksi ke 2 yang kita butuhkan adalah C nya dimana sudah sama sama letaknya direaktan dan koefisiennya 1 mol. Jadi tidak usah diubah.
4. C(s) + O2(g) ==> CO2(g) = - 359 kJ/mol
= - 359 kJ/mol
Langkah terakhir jumlahkan reaksi 3 dan 4
2MgO(s) ==> 2Mg(s) + O2(g) = + 1200 kJ/mol
= + 1200 kJ/mol
C(s) + O2(g) ==> CO2(g) = - 359 kJ/mol
= - 359 kJ/mol
2MgO(s) + C(s) ==> 2Mg(s) + CO2(g) reaksi = + 841 kJ/mol
reaksi = + 841 kJ/mol
Nah cara diatas kalian gunakan jika soalnya Essay. Tapi jika soalnya obejktif, ngak nusah kayak diatas. Kalian perhatikan saja perubahan entalpinya.
Misalkan reaksi pertama kan MgOnya dibalik jadi jadi +, kemudian koefiennya dikali 2, maka harga
jadi +, kemudian koefiennya dikali 2, maka harga  juga dikali 2 hasilnyya adalah = + 1200 kJ
juga dikali 2 hasilnyya adalah = + 1200 kJ
Kemudian pada reaksi kedua kan yang dibutuhkan C dan tidak dibalik dan tidak diubah koefieinnya. Maka harga sama saja yaitu = - 359 kJ/mol
sama saja yaitu = - 359 kJ/mol
Nah tinggal jumlahin hasilnya pasti sama..
Nah itulah tadi telah diuraikan mengenai Soal Ujian Akhir Semester Ganjil Kelas XI. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
>
Soal 1
Ion X+ mempunyai konfigurasi elektron 1s2 2s2 2p6 . Harga keempat bilangan kuantum dari elektron valesni atom X adalah . . . .
Pembahasan:
Bilangan kuantum itu terdiri dari n, l , m dan s yang namanya pasti sudah kalian ketahui. Pada soal diatas diberikan konfigurasi ion yang ditayakan bilangan kuantum adalah atomnya. Untuk itu kita perlu mengetahui konfigurasi elektron atom X itu.
Ion positif adalah ion yang terbentuk ketika sebiah atom melepas elektronnya. Jika muatannnya +1, berarti melepas 1 buah elektron, jika +2 maka artinya atom telah melepas 2 buah elektron dan seterusnya.
Pada soal diketahui konfigurasi ion X+, artinya atom X telah melepas 1 buah elektron. Ada dua cara menentukan konsfigurasi elektron atom X dari ion X+.
1. Menghitung jumlah elektron ion X+ kemudian ditambah 1 buah elektron yang dilepaskan. Ini adalah cara termudah menurut saya. Karena sebagian dari kita mungkin tidak terlalu hafal urutan pengisian elektron pada orbital.
Konsfigurasi elektron ion X+ = 1s2 2s2 2p6, jumlah elektron = 2 + 2 + 6 = 10
Maka jumlah elektron atom X adalah = Jumlah elektron ion X+ + elektron yang dilepaskan
= 10 + 1
= 11 elektron
Konfigurasi elektron atom X = 1s2 2s2 2p6 3s1
Kulit valensi = 3s1
Diagram orbital
[I ]
Nilai n = 3(tingkat energi orbitalnya)
l = 0 (s)
m = 0 (karena nilai m = -l, 0 , +l)
s = +1/2 karena arah perputaran elektron keatas
2. Kalian tulis aturan pengisian elektron dalam orbital menurut aufbau. Menulisnya tentu tidak perlu menghafalnya karena punya pola yang bisa dengan mudah diingat. Kemudian kalian lihat orbital apa setelah orbital terakhir ion yang diketahui nah itulah yang akan kita isi dengan sejumlah elektron yang dilepaskan atom untuk membentuk ion tersebut.
Pada soal diatas, atom X melepas 1 buah elektron untuk membentuk ion X+ dan orbital terakhirnya adalah 2p, sehingga untuk membuat konfigurasi elektron X, satu buah elektron yang dilepaskan ditempatkan pada orbital 3s. Dari cara ini kita bisa langsung mendapatkan konfigurasi atom dari ion yang diketahui.
Namun tentu terserah kalian mau pilih cara yang mana. Yang mudah saat ujian tentu akan lebih bagus karena kita harus berpacu dengan waktu.
Soal 2
Jumlah orbital yang diisi oleh elektron tidak berpasangan pada atom Fe dengan nomor atom 56 adalah . .. . . .?
Pembahasan
Soal ini juga membutuhkan kemahiran kalian dalam menggambar diagram orbital.
Fe dengan nomor atom 26 memiliki konfigurasi sebagai berikut :
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Jika kita perhatikan konfigurasi diatas mulai dari orbital 1s sampai 4s telah penuh terisi oleh elektron (sub kulit s = max 2e, sub kulit p = mas 6e), sehingga kita hanya perlu menggambar digaram orbital 3d.
Diagram orbital 3d sebagai berikut:
Soal 7
Perhatikanlah rekasi kesetimbangan berikut :
2SO2(g) + O2(g) <==> 2SO3(g) = - 197,8 kJ/mol
= - 197,8 kJ/mol
Gambar partikel pada keadaan setimbang mula mula sebagai berikut :
Jika suhu dinaikkan, gambar partikel perekasi kesetimbangan sesaat yang baru adalah . . . . .
Pembahasan
Nah ini adalah salah satu soal yang memakai konsep faktor faktor yang memengaruhi laju reaksi. Pada soal ini yang ditanya adalah pengaruh suhu, maka kalian harus mengetahui jenis reaksi kesetimbangan apakah eksoterm atau endoterm.
Jika suhunya dinaikkan maka kesetimbangan aan bergeser kearah reaksi endoterm dan sebaliknnya jika suhu diturunkan maka kesetimbangan akan bergeser kearah reaksi endoterm.
Pada soal diatas, reaksinya tergolong eksoterm kearah pembentukan SO3 dan endoterm kearah penguraian SO3 ( pembentukan SO2 dan O2). Jika suhu dinaikkan maka kesetimbangan akan bergeser kearah reaksi endoterm yaitu kearah pembentukan SO2 dan O2 yang akan lebih banyak.
Nah, soal ini tidak sampai disini, kita justru diminta menunjukkan dengan gambar mana keadaan ini tepat. Pada soal yang ditanya kan hanya partikel perekasi saja, maka jumlah SO2 dan O2 akan lebih banyak dari semula. Gambar yang menunjuukkan keadaan tersebut yang tepat adalah gambar option C.
Soal 8
Pada reaksi kesetimbangan N2O4(g) <==> 2NO2(g) diperoleh mol N2O4 dan 2NO2 yang sama. Derajat disosiasi dari N2O4 adalah . . . .?
Pembahasan
Pertama kita buat dulu stoikiometri rekasinya ya dengan memisalkan mol N2O4 pada saat setimbang adalah a.
N2O4(g) <==> 2NO2(g)
Mula Mula
Reaksi 1/2 a <== a
Sisa a ==> a
Jika pada saat setimbang terdapat a mol N2O4, maka jumlah mol NO2 yang ada pada saat setimbang juga a mol, karena mol mereka sama. Jika terdapat a mol NO2 pada saat setimbang, maka tentunya pada saat reaksi juga terbentuk a mol NO2 yang semula tidak ada. Dengan menggunakan prinsip perbandingan koefisien, maka kita dapatkan mol N2O4 yang bereaksi adalah 1/2 a mol.
Jumlah mol N2O4 mula mula = Reaksi + sisa = 1/2 a + a = 3/2 a
Derajat disosiasi = mol reaksi / mol mula mula = 1/2 a/ 3/2 a = 1/3
Soal 9
Pada reaksi kesetimbangan : 2NH3(g) ==> N2(g) + 3H2(g) pada suhu 27 derajat Celsius mempunyai harga Kp = 2,46. Harga Kc reaksi tersebut adalah . . . .?
Pembahasan
Ini soal tentang hubungan Kc dengan Kp, yaitu :^{\Delta&space;n})
Karena yang akan dicari Kc, maka rumusnya menjadi :
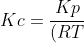^{\Delta&space;n}})
Delta n adalah selisih koefisien produk dan reaktan. Pada reaksi diatas, selisihnya adalah = 4 - 2 = 2
^{2}})
Nah, tinggal kalian cari sendiri hasilnya. Mudah kan.
Soal 10
Harga tetapan kesetimbangan untuk reaksi : 2X(g) <==> 3Y(g) pada temperatur tertentu adalah 1/8. Jika pada saat setimbang tekanan parsial X adalah 8 atm, maka tekanan parsial Y adalah . . . .
Pembahasan :
Kita buat dulu rumus Kp dari reaksi diatas.
^{3}}{P(X)^{2}})
Nah yang ditanya kan tekanan parsial Y, maka rumusnya menjadi seperti ini :
^3&space;=&space;Kp&space;P(X)^{2})
^3&space;=&space;1/8&space;.&space;(8)^{2})
^3&space;=&space;8&space;==%3E&space;P(Y)&space;=&space;2)
Soal 11
Diketahui reaksi :
Cl2(g) + 2NO(g) ==> 2NOCl(g)
Jika konsentrasi pereaksi diperbesar dua kali, kecepatan reaksinya menjadi 8 kali semula. Jika hanya Cl2 yang diperbesar 2 kali, kecepatannya menjadi 2 kali semula. Orde reaksi terhadap NO adalah . . . .?
Pembahasan
Soal ini menuntut kemampuan kalian untuk menerjemahkan soal. Kita biasanya disuruh mencari orde reaksi ya diketahui datanya dalam tabel. Soal ini sebenarnya mirip hanya saja kita harus buat tabelnya sendiri berdasarkan soal diatas.
Kita misalkan persaaan umum laju reaksi awalnya adalah :
a = [b]^x [c]^y
Dengan a adalah laju reaksi, b adalah Cl2 dan c adalah NO. Dibuat seperti ini agar lebih simpel saja agar mudah dimengerti.
Jika konsentrasi Cl dan NO diperbesar 2 kali semula maka laju reaksinya menjadi 8 kali semula.
b1 = 2b
c2 = 2c
a1 = 8a
Persamaan laju reaksinya menjadi :
a1 = [b1]^x [c1]^y
8a = [2b}^x [2c]^y (1)
Jika konsentrasi a saja diperbesar 2 kali, maka laju reaksinya menjadi 2 kali semula.
b2 = 2b
c2 = c
a2 = 2a
Persamaan laju reaksinya menjadi
a2 = [b2]^x [c2]^y
2a = [2b]^x [c]^y (2)
Kemusian persmaan 1 dan 2 kita bagi, jadinya seperti ini :
![\frac{V1}{V2} =\frac{[2b]^{x}[2c]^{y}}{[[2b]^{x}][c]^{y}}](https://latex.codecogs.com/gif.latex?\frac{V1}{V2}&space;=\frac{[2b]^{x}[2c]^{y}}{[[2b]^{x}][c]^{y}})
![\frac{8a}{2a} =\frac{[2b]^{x}[2c]^{y}}{[2b]^{x}[c]^{y}}](https://latex.codecogs.com/gif.latex?\frac{8a}{2a}&space;=\frac{[2b]^{x}[2c]^{y}}{[2b]^{x}[c]^{y}})

y = 2
Y adalah orede reaksi terhadap NO, jadi jawabannya adalah 2.
Aatau agar lebih mudah kalian bisa buat tabel
[Cl] [NO] Laju reaksi
b c a (1)
2b 2c 8a (2)
2b c 2a (3)
Untuk mendapatkan orde reaksi terhadap NO maka kalian bandingkan dua persamaan yang nilai [Cl] nya sama yaitu persamaan 2 dan 3. Hasilnya akan sma dengan yang diatas.
Soal 12
Pada reaksi x + y ==> xy, diperoleh data sebagai berikut :
No [x] [y] Laju reaksi
1 0,1 M 0,05 M 20 M/s
2 0,3 M 0,05 M 180 M/s
3. 0,1 M 0,20 M 320 M/s
Persamaan laju reaksinya adalah . . . .?
Pembahasan
Kelanjutan dari soal diatas, ini soal yang lebih mudah dimana kita dikasih datanya. Untuk menentukan persamaan laju reaksi kita harus tahu orde reaksi masing masing perekasi.
Misalkan dulu persamaan laju reaksi untuk reaksi : x + y ==> xy
![V = k [x]^{a}[y]^{b}](https://latex.codecogs.com/gif.latex?V&space;=&space;k&space;[x]^{a}[y]^{b})
Dengan a adalah orde terhadap x dan b adalah orde terhadap y.
Mencari a ===> cari konsentrasi y yang sama yaitu percobaan nomor 1 dan 2
![\frac{V2}{V2} = \frac{[0,3]^{a}[0,5]^{b}}{[0,1]^{a}[0,5]^{b}}](https://latex.codecogs.com/gif.latex?\frac{V2}{V2}&space;=&space;\frac{[0,3]^{a}[0,5]^{b}}{[0,1]^{a}[0,5]^{b}})

a = 2
Mencari b ==> cari konsentrasi x yang sama yaitu percobaan nomor 1 dan 3
![\frac{V3}{V1} = \frac{[0,1]^{a}[0,20]^{b}}{[0,1]^{a}[0,05]^{b}}](https://latex.codecogs.com/gif.latex?\frac{V3}{V1}&space;=&space;\frac{[0,1]^{a}[0,20]^{b}}{[0,1]^{a}[0,05]^{b}})
![\frac{320}{20} = \frac{[0,20]^{b}}{[0,05]^{b}}](https://latex.codecogs.com/gif.latex?\frac{320}{20}&space;=&space;\frac{[0,20]^{b}}{[0,05]^{b}})
a = 2
Jadi persamaan laju rekasinya menjadi :![V = k [x]^{2}[y]^{2}](https://latex.codecogs.com/gif.latex?V&space;=&space;k&space;[x]^{2}[y]^{2})
Soal 13
Berikut ini diberikan data percobaan laju reaksi : Q(g) + 2T(g) ==> T2Q(g) pada beberapa kondisi :
No [Q] [T] V (M/s)
1 0,1 0,1 1,25 x 10^-2
2 0,2 0,1 5 x 10^-2
3 0,1 0,2 10^-1 = 10 x 10^-2
Jika [Q] dan [T] masing masing diubah menjadi 0,5 M maka harga laju reaksinya menjadi . . . ..?
Pembahasan :
Soal ini sama saja jalannya dengan soal soal diatas, hanya ditambah pertanyaan lebih. Untuk menjawabnya kita tentu harus menulis persamaan laju reaksi untuk reaksi diatas beserta orde orde rekasinya.
Misalkan persamaan laju reaksinya sebagai berikut :
V = k [Q]^x [T]^y
Mencari harga x ==> cari [T] yang sama yaitu kondisi 1 dan 2
![\frac{V2}{V1} = \frac{[0,2]^{x}[0,1]^{y}}{[0,1]^{x}[0,1]^{y}}](https://latex.codecogs.com/gif.latex?\frac{V2}{V1}&space;=&space;\frac{[0,2]^{x}[0,1]^{y}}{[0,1]^{x}[0,1]^{y}})
Ion X+ mempunyai konfigurasi elektron 1s2 2s2 2p6 . Harga keempat bilangan kuantum dari elektron valesni atom X adalah . . . .
Pembahasan:
Bilangan kuantum itu terdiri dari n, l , m dan s yang namanya pasti sudah kalian ketahui. Pada soal diatas diberikan konfigurasi ion yang ditayakan bilangan kuantum adalah atomnya. Untuk itu kita perlu mengetahui konfigurasi elektron atom X itu.
Ion positif adalah ion yang terbentuk ketika sebiah atom melepas elektronnya. Jika muatannnya +1, berarti melepas 1 buah elektron, jika +2 maka artinya atom telah melepas 2 buah elektron dan seterusnya.
Pada soal diketahui konfigurasi ion X+, artinya atom X telah melepas 1 buah elektron. Ada dua cara menentukan konsfigurasi elektron atom X dari ion X+.
1. Menghitung jumlah elektron ion X+ kemudian ditambah 1 buah elektron yang dilepaskan. Ini adalah cara termudah menurut saya. Karena sebagian dari kita mungkin tidak terlalu hafal urutan pengisian elektron pada orbital.
Konsfigurasi elektron ion X+ = 1s2 2s2 2p6, jumlah elektron = 2 + 2 + 6 = 10
Maka jumlah elektron atom X adalah = Jumlah elektron ion X+ + elektron yang dilepaskan
= 10 + 1
= 11 elektron
Konfigurasi elektron atom X = 1s2 2s2 2p6 3s1
Kulit valensi = 3s1
Diagram orbital
[I ]
Nilai n = 3(tingkat energi orbitalnya)
l = 0 (s)
m = 0 (karena nilai m = -l, 0 , +l)
s = +1/2 karena arah perputaran elektron keatas
2. Kalian tulis aturan pengisian elektron dalam orbital menurut aufbau. Menulisnya tentu tidak perlu menghafalnya karena punya pola yang bisa dengan mudah diingat. Kemudian kalian lihat orbital apa setelah orbital terakhir ion yang diketahui nah itulah yang akan kita isi dengan sejumlah elektron yang dilepaskan atom untuk membentuk ion tersebut.
Pada soal diatas, atom X melepas 1 buah elektron untuk membentuk ion X+ dan orbital terakhirnya adalah 2p, sehingga untuk membuat konfigurasi elektron X, satu buah elektron yang dilepaskan ditempatkan pada orbital 3s. Dari cara ini kita bisa langsung mendapatkan konfigurasi atom dari ion yang diketahui.
Namun tentu terserah kalian mau pilih cara yang mana. Yang mudah saat ujian tentu akan lebih bagus karena kita harus berpacu dengan waktu.
Soal 2
Jumlah orbital yang diisi oleh elektron tidak berpasangan pada atom Fe dengan nomor atom 56 adalah . .. . . .?
Pembahasan
Soal ini juga membutuhkan kemahiran kalian dalam menggambar diagram orbital.
Fe dengan nomor atom 26 memiliki konfigurasi sebagai berikut :
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Jika kita perhatikan konfigurasi diatas mulai dari orbital 1s sampai 4s telah penuh terisi oleh elektron (sub kulit s = max 2e, sub kulit p = mas 6e), sehingga kita hanya perlu menggambar digaram orbital 3d.
Diagram orbital 3d sebagai berikut:
Terlihat dari digram orbital diatas bahwa ada 4 buah elektron yang tidak berpasangan. Agar lebih cepat menjawabnya, kalian tidak usah membuat diagram orbitalnya. Asalkan tahu setiap kulit punya orbital berapa. Atom Fe diatas memiliki 6 buah elektron pada orbital d-nya dimana kita harus mengisi masing masing satu buah elektron, kemudian baru berpasangan. Karena subkulit d memiliki 5 buah orbital, maka untuk mengisi satu satu orbital tersebut dibutuhkan 5 elektron, sisa satu. Nah yang satu ini baru dipasangkan. Artinya hanya 1 buah orbital yang berisi elektron berpasangan, sedangkan yang lain menyendiri sebanyak 4 buah.
Soal 3
Diantara unsur 3P, 12Q, 19R, 33S dan 53T yang terletak pada blok P adalah . .
Pembahasan :
Untuk menjawab soal ini kita hanya perlu membuat konfigurasi elektronnya saja.
Jika ujung konsfigurasinya ns = blok s
Jika ujung konfigurasinya ns np = blok p
Jika ujung konfigurasinya ns (n-1)d = blok d dan f
3 P = 1s2 2s1 ==> blok s
12 Q = 1s2 2s2 2p6 3s2 ==> blok s
19 R = 1s2 2s2 2p6 3s2 3p6 4s1 ==> blok s
33 S = 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 ==> blok p
53 T = 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5 ==> blok p
S dan T terletak pada blok p.
Soal 4
Suatu unsur netral mempunyai 2 buah elektron dikulit pertama, 8 buah elektron dikulit kedua, dan 5 buah elektron pada kulit ketiga. Jumlah elektron yang menempati orbital P netral tersebut adalah . . . .
Pembahasan :
Wah soal ini mah sebenarnya mudah, hanya dibuat menjadi soal cerita saja agar soalnya panjang, jadi kalian harus bisa memahami solnya ya.
Atom P netrals mempunyai:
Kulit 1 = K = 2e
Kulit 2 = L = 8e
Kulit 3 = M = 5 e
Yang ditanyakan dalam soal adalah berapa buah elektron yang menempati kulit P?
Langkah pertama adalah menghitung jumlah elektron, kemudian membuat konfigurasi elektronnya. Mudah kan.
Jumlah elektron P = 2 + 8 + 5 = 15 e
Konfigurasi elektron:
1s2 2s2 2p6 3s2 3p3
Dari konsfigurasi elektron P diatas kita bisa lihat bahwa ada 9 elektron yang mengisi orbital P yaitu orbital 2p6 dan 3p3.
Soal 5
Diantara pasangan unsur dibawah ini yang memiliki jumlah elektron valensi yang sama adalah . . . . .
A. 3 Li dan 13 Al
B. 5 B dan 21 Sc
C. 7 N dan 17 Cl
D. 11 Na dan 17 Cl
E. 12 Mg dan 19 K
Pembahasan
Jika kalian hafal unsur golongan A dalam sitem periodik maka kalian boleh menulis konfigurasi berdasarkan kulit saja. Karena agak panjang sih menentukan elektron valensi dengan konfigurasi orbital. Elektron valensi adalah elektron pda kulit terakhir.
Semua unsur dalam option diatas adalah unsur golongan A kecuali Sc. Jadi untuk aatom Sc kita pakai konfigurasi orbital.
A. 3 Li = 2 1 ev = 1
13 Al = 2 8 3 ev = 3
B. 5 B = 2 3 ev = 3
21 Sc = 1s2 2s2 2p6 3s3 3p6 4s2 3d1 Kulit valensi = 4s2 3d1 , ev = 3
C. 7 N = 2 5 ev = 5
17 Cl = 2 8 7 ev = 7
D. 11 Na = 2 8 1 ev = 1
17 Cl = 2 8 7 ev = 7
E. 12 Mg = 2 8 2 ev = 2
19 K = 2 8 8 1 ev = 1
Jawaban : B
Soal 6
Konfigurasi elektron dibawah ini yang termasuk unsur golongan alkali tanah adalah. . . .
A. 1s2 2s2 2p6 3s1
B. 1s2 2s2 2p6 3s2 3p2
C. 1s2 2s2 2p6 3s2 3p6 3d2 4s2
D. 1s2 2s2 2p6 3s2 3p6 3d 4s2
E. 1s2 2s2 2p6 3s2 3p6 4s2
Pembahasan
Golongan Valensi Nama
IA ns1 Alkali
IIA ns2 Alkali Tanah
IIIA ns2 np1 Aluminium
IVA ns2 np2 Karbon
VA ns2 np3 Nitrogen
VIA ns2 np4 Oksigen
VIIA ns2 np5 Halogen
VIIIA ns2 np6 Gas mulia
B ns (n-1)d Transisi
Jawaban : E
Catatan : konfigurasi C dan D itu telah disusun, yang seharusnya diisi terlebih dahulu adalah 4s kemudian 3d, sehingga unjung konfigurasinya bukan s tetapi d.
Perhatikanlah rekasi kesetimbangan berikut :
2SO2(g) + O2(g) <==> 2SO3(g)
Gambar partikel pada keadaan setimbang mula mula sebagai berikut :
Jika suhu dinaikkan, gambar partikel perekasi kesetimbangan sesaat yang baru adalah . . . . .
Pembahasan
Nah ini adalah salah satu soal yang memakai konsep faktor faktor yang memengaruhi laju reaksi. Pada soal ini yang ditanya adalah pengaruh suhu, maka kalian harus mengetahui jenis reaksi kesetimbangan apakah eksoterm atau endoterm.
Jika suhunya dinaikkan maka kesetimbangan aan bergeser kearah reaksi endoterm dan sebaliknnya jika suhu diturunkan maka kesetimbangan akan bergeser kearah reaksi endoterm.
Pada soal diatas, reaksinya tergolong eksoterm kearah pembentukan SO3 dan endoterm kearah penguraian SO3 ( pembentukan SO2 dan O2). Jika suhu dinaikkan maka kesetimbangan akan bergeser kearah reaksi endoterm yaitu kearah pembentukan SO2 dan O2 yang akan lebih banyak.
Nah, soal ini tidak sampai disini, kita justru diminta menunjukkan dengan gambar mana keadaan ini tepat. Pada soal yang ditanya kan hanya partikel perekasi saja, maka jumlah SO2 dan O2 akan lebih banyak dari semula. Gambar yang menunjuukkan keadaan tersebut yang tepat adalah gambar option C.
Soal 8
Pada reaksi kesetimbangan N2O4(g) <==> 2NO2(g) diperoleh mol N2O4 dan 2NO2 yang sama. Derajat disosiasi dari N2O4 adalah . . . .?
Pembahasan
Pertama kita buat dulu stoikiometri rekasinya ya dengan memisalkan mol N2O4 pada saat setimbang adalah a.
N2O4(g) <==> 2NO2(g)
Mula Mula
Reaksi 1/2 a <== a
Sisa a ==> a
Jika pada saat setimbang terdapat a mol N2O4, maka jumlah mol NO2 yang ada pada saat setimbang juga a mol, karena mol mereka sama. Jika terdapat a mol NO2 pada saat setimbang, maka tentunya pada saat reaksi juga terbentuk a mol NO2 yang semula tidak ada. Dengan menggunakan prinsip perbandingan koefisien, maka kita dapatkan mol N2O4 yang bereaksi adalah 1/2 a mol.
Jumlah mol N2O4 mula mula = Reaksi + sisa = 1/2 a + a = 3/2 a
Derajat disosiasi = mol reaksi / mol mula mula = 1/2 a/ 3/2 a = 1/3
Soal 9
Pada reaksi kesetimbangan : 2NH3(g) ==> N2(g) + 3H2(g) pada suhu 27 derajat Celsius mempunyai harga Kp = 2,46. Harga Kc reaksi tersebut adalah . . . .?
Pembahasan
Ini soal tentang hubungan Kc dengan Kp, yaitu :
Karena yang akan dicari Kc, maka rumusnya menjadi :
Delta n adalah selisih koefisien produk dan reaktan. Pada reaksi diatas, selisihnya adalah = 4 - 2 = 2
Nah, tinggal kalian cari sendiri hasilnya. Mudah kan.
Soal 10
Harga tetapan kesetimbangan untuk reaksi : 2X(g) <==> 3Y(g) pada temperatur tertentu adalah 1/8. Jika pada saat setimbang tekanan parsial X adalah 8 atm, maka tekanan parsial Y adalah . . . .
Pembahasan :
Kita buat dulu rumus Kp dari reaksi diatas.
Nah yang ditanya kan tekanan parsial Y, maka rumusnya menjadi seperti ini :
Soal 11
Diketahui reaksi :
Cl2(g) + 2NO(g) ==> 2NOCl(g)
Jika konsentrasi pereaksi diperbesar dua kali, kecepatan reaksinya menjadi 8 kali semula. Jika hanya Cl2 yang diperbesar 2 kali, kecepatannya menjadi 2 kali semula. Orde reaksi terhadap NO adalah . . . .?
Pembahasan
Soal ini menuntut kemampuan kalian untuk menerjemahkan soal. Kita biasanya disuruh mencari orde reaksi ya diketahui datanya dalam tabel. Soal ini sebenarnya mirip hanya saja kita harus buat tabelnya sendiri berdasarkan soal diatas.
Kita misalkan persaaan umum laju reaksi awalnya adalah :
a = [b]^x [c]^y
Dengan a adalah laju reaksi, b adalah Cl2 dan c adalah NO. Dibuat seperti ini agar lebih simpel saja agar mudah dimengerti.
Jika konsentrasi Cl dan NO diperbesar 2 kali semula maka laju reaksinya menjadi 8 kali semula.
b1 = 2b
c2 = 2c
a1 = 8a
Persamaan laju reaksinya menjadi :
a1 = [b1]^x [c1]^y
8a = [2b}^x [2c]^y (1)
Jika konsentrasi a saja diperbesar 2 kali, maka laju reaksinya menjadi 2 kali semula.
b2 = 2b
c2 = c
a2 = 2a
Persamaan laju reaksinya menjadi
a2 = [b2]^x [c2]^y
2a = [2b]^x [c]^y (2)
Kemusian persmaan 1 dan 2 kita bagi, jadinya seperti ini :
y = 2
Y adalah orede reaksi terhadap NO, jadi jawabannya adalah 2.
Aatau agar lebih mudah kalian bisa buat tabel
[Cl] [NO] Laju reaksi
b c a (1)
2b 2c 8a (2)
2b c 2a (3)
Untuk mendapatkan orde reaksi terhadap NO maka kalian bandingkan dua persamaan yang nilai [Cl] nya sama yaitu persamaan 2 dan 3. Hasilnya akan sma dengan yang diatas.
Soal 12
Pada reaksi x + y ==> xy, diperoleh data sebagai berikut :
No [x] [y] Laju reaksi
1 0,1 M 0,05 M 20 M/s
2 0,3 M 0,05 M 180 M/s
3. 0,1 M 0,20 M 320 M/s
Persamaan laju reaksinya adalah . . . .?
Pembahasan
Kelanjutan dari soal diatas, ini soal yang lebih mudah dimana kita dikasih datanya. Untuk menentukan persamaan laju reaksi kita harus tahu orde reaksi masing masing perekasi.
Misalkan dulu persamaan laju reaksi untuk reaksi : x + y ==> xy
Dengan a adalah orde terhadap x dan b adalah orde terhadap y.
Mencari a ===> cari konsentrasi y yang sama yaitu percobaan nomor 1 dan 2
a = 2
Mencari b ==> cari konsentrasi x yang sama yaitu percobaan nomor 1 dan 3
a = 2
Jadi persamaan laju rekasinya menjadi :
Soal 13
Berikut ini diberikan data percobaan laju reaksi : Q(g) + 2T(g) ==> T2Q(g) pada beberapa kondisi :
No [Q] [T] V (M/s)
1 0,1 0,1 1,25 x 10^-2
2 0,2 0,1 5 x 10^-2
3 0,1 0,2 10^-1 = 10 x 10^-2
Jika [Q] dan [T] masing masing diubah menjadi 0,5 M maka harga laju reaksinya menjadi . . . ..?
Pembahasan :
Soal ini sama saja jalannya dengan soal soal diatas, hanya ditambah pertanyaan lebih. Untuk menjawabnya kita tentu harus menulis persamaan laju reaksi untuk reaksi diatas beserta orde orde rekasinya.
Misalkan persamaan laju reaksinya sebagai berikut :
V = k [Q]^x [T]^y
Mencari harga x ==> cari [T] yang sama yaitu kondisi 1 dan 2
Loading...
Mencari harga y ==> cari [Q ] yang sama yaitu kondisi 1 dan 3
Jadi persamaan laju rekasinya menjadi :
Nah belum selesai, kita cari harga k nya dulu dengan cara memakai salah satu kondisi. Saya pakai yang pertama saja.
Jika [P] = [Q] = 0,5 M
V = 1250 (0,5)^2 (0,5)^3
= 1250 x 125 x 10^-5
= 1,5625 M/s
Soal 14
Diketahui pembakaran gas asetilen menurut reaksi :
2C2H2(g) + 5O2(g) ==> 4CO2(g) + 2H2O(l)
Pada reaksi tersebut untuk pembakaran 10 L gas C2H2 pada keadaan standar STP melepas kalor sebanyak . . . .
Pembahasan
Nah jika kita perhatikan reaksi :
2C2H2(g) + 5O2(g) ==> 4CO2(g) + 2H2O(l)
Untuk itu kita ubah menjadi
C2H2(g) + 5/2O2(g) ==> 2CO2(g) + H2O(l)
Untuk pembakaran 10 L gas C2H2, karena suhunya adalah 25 (25 + 273 = 298 K) derajat Celsius maka untuk mencari mol kita gunakan persamaan gas ideal yaitu :
n = P.V/R.T
= 1 atm . 10 L / 0,082 L atm mol -1 K -1 . 298 K
= 10/24,436 mol
= 0,409 mol
mol C2H2 = P.V/R T
= 0,409 mol x - 1299,5 kJ/mol
= 531,8 kJ
Soal 15
Diketahui energi ikatan rata rata :
C
C - C : 343 kJ/mol
H - H : 436 kJ/mol
C - H : 410 kJ/mol
Perubahan entalpi yang terjadi pada reaksi berikut :
CH3 - C
Pembahasan
Ini adalah konsep menghitung harga perubahan entalpi menggunakan data energi ikatan. Kalian harus buat jenis ikatan yang terdapat pada masing masing senyawa pada reaksi diatas untuk mengetahui jumlah ikatn tunggal maupun rangkap. Saya tidak buat gambar jenis ikatannya, tapi akan saya jabarkan saja.
Reaktan
Senyawa : CH3 - C
Senyawa 2 H2, dalam sebuah senyawa terdapat 1 buah ikatan H - H. Karena senyawanya ada 2, maka terdapat 2 buah ikatan H - H
Produk
Senyawa : CH3 - CH2 - CH3, terdapat 8 buah ikatan C - H dan 2 buah ikatan C - C.
Jika ada ikatan yang sama maka kita kurangkan dari yang banyak. Misalnya
Direaktan ada 4 ikatan C - H, sedangkan produk ada 8 buah ikatan C - H. Maka jika kita coret karena enerinya sama, maka akan bersisa di produk sebanyak 4 buah sedangkan direaktan sudah tidak ada. Begitu seterusnya jadi di reaktan ikatan C - C nya habis dan diproduk sisa 1.
Energi pemutusan ikatan reaktan
= 1 x C
Energi pemutusan ikatan produk
= (4. C H + 1 . C - C) = (4. 410 + 1. 343 ) = 1983 kJ/mol
= 1711 - 1983
= - 272 kJ/mol
Soal 16
Perhatikan gambar diagram entalpi berikut
Berdasarkan diagram entalpi tersebut jenis reaksi dan alasan yang tepat adalah?
Pembahasan :
Nah pada soal ini kita diminta membaca gamabar kemudian menuliskan kesimpulan. Soal ini mudah sebenarnya apalagi sudah diketahui harga
Karena
Soal 17
Perhatikanlah gambar bentuk molekul dibawah ini.
Bentuk molekul tersebut dimiliki oleh senyawa . . . . (Nomor atom H = 1, O = 8, P =15, Cl = 17, F = 19, Te = 52 dan Xe = 54)
A. H2O
B. PCl5
C. ClF3
D. TeCl4
E. XeF2
Pembahasan :
Perhatikanlah bentuk molekulnya dengan seksama. Atom pusatnya ada ditengah dan memiliki 4 buah ikatan dengan atom lain dan satu buah pasangan elektron bebas. Pastinya jumlah atom penusun dalam senyawa tersebut adalah 5 yaitu 1 buah atom pusat dan 4 buah atom cabang.
Dari penalaran diatas kita bis tarik kesimpulan bahwa jawabannya pasti TeCl4 karena hanya senyawa ini yang mempunyai 5 buah atom penyusun molekulnya. Dengan cara ini sebenarnya kalian tidak perlu terlalu hafal tabel bentuk molekul senyawa yang cukup banyak itu. Tapi tentu jika hafal akan lebih baik bukan. Karena ini untuk persiapan ujian jadi saya kasih cara singkat saja.
Untuk memastikannya, marilah kita cari bentuk molekul dari senyawa TeCl4.
Atom pusat = Te , Konfigurasi = 2 8 18 18 6, ev = 6
Atom Cabang = 4 Cl, Konfigurasi = 2 8 7, ev = 7
Untuk mencari jumlah elektron bebas kita bisa pakai rumus beriku:
E = (ev Atom pusat - pei)/2 = (6 - 4)/2 = 1
Nah dapat dibuktikan bahwa gambar molekul pada soal diatas adalah bentuk molekul dari senyawa TeCl4 dengan 4 buah pasangan elektron ikatan dan 1 buah pasangan elektron bebas.
Soal 18
JIka nomor atom C = 6 dan nomor atom H = 1, bentuk molekul dari CH4 adalah . . . .?
Pembahasan :
Kita gunakan konsep teori domain elektron untuk menentukan bentuk molekulnya. Syaratnya ya kalian harus hafal tipe molekul berdasarkan teori ini.
Pertama buat konsfigurasi dulu untuk menentukan jenis ikatan kovalen antara C dan H. Kalian pasti sudah tahu jenisnya kan.
6 C = 2 4 , ev = 4 ==> Atom Pusat
1 H = 1 , ev = 1 ==> Atom Cabang
Atom H hanya butuh sebuah elektron lagi agar duplet, sehingga dia akan berikatan tunggal dengan atom C.
Berarti jumlah pasangan elektron ikatannya = X = 4
Kemudian kita tentukan pasangan elektron bebasnya.
PEB = E = (ev Atom pusat - pei)/2 = (4 - 4)/2 = 0
Jadi pada molekul CH4 terdapat 4 buah PEI dan 0 buah PEB, sehingga tipe molekulnya adalah AX4. Bentuk molekul dengan tipe ini adalah tetrahedral.
Soal 19
Diketahui rumus senyawa dan orbital hibridanya sebagai berikut.
No Rumus Senyawa Orbital hibrida
1 CCl4 sp3
2 SbCl5 sp3d3
3 BCl3 sp
4 H2S sp3
(nomor atom C= 6, Cl = 17, Sb = 51, B = 5 dan S = 16)
Pasangan rumus senyawa dengan orbital hibridanya yang tepat ditunjukkan oleh nomor. . . .?
Pembahasan
Saya contohkan satu buah saja cara mencarinya dan kalian pasti akan bisa membuat untuk senyawa lain.
Senyawa CCl4
Yang kita perhatikan adalah elektron valensi atom pusat dan atom cabang.
6 C = 1s2 2s2 2p2, ev = 4
17 Cl = 1s2 2s2 2p6 3s2 3p5 , ev = 7
4 buah atom Cl pada senyawa CCl4 hanya membutuhkan satu buah elektron lagi dari atom pusat C, jadi atom C total harus menyediakan 4 buah elektron menyendiri untuk dipasangkan dengan Cl.
Diagram orbital C
Proses eksitasi dan hibridisasi
Soal 20
Diketahui harga keelektronegatifan Br = 2, 7 dan Cl = 2,8. Gaya antar molekul yang terjadi pada senyawa BrCl berupa . . . . .
A. Ikatan ion
B. Gaya london
C. ikatan hidrogen
D. gaya dipol sesaat
E. gaya tarik dipol
Pembahasan :
Untuk mengetahuai jenis gaya antar molekul yang terjadi antara senyawa BrCl maka kita harus identifikasi dulu apakah senyawa polar atau non polar.
Senyawa polar adalah senyawa yang perbedaan keelektronegatifannya kecil atau bahakan 0. Jika kita hitung selisih keelektronegatifan antara Br dan Cl dalam senyawa BrCl hanya 0,1 yaitu tergolong kecil. Sehingga dapat kita simpulkan bahwa senyawa BrCl adalah senyawa nonpolar.
Interaksi atau gaya antrar molekul yang terjadi antara dua molekul nonpolar disebut gaya london.
Ikatan ion = ikatan antar atom dalam molekul
Ikatan hidrogen = ikatan antara atom H dengan atom yang sangat elektronegatif. Jadi senyawanya harus mempunyai atom. Ikatan ini paling banyak terjadi dalam molekul NH3, H2O dan HF.
Soal 21
Diberikan beberapa senyawa sebagau berikut:
1. HF 4. HCl
2. NH3 5. CH4
3. H2O
Berdasarkan informasi diatas. senyawa senyawa yang mengandung ikatan hidrogen adalah senyawa denga nomor. . . . .
Pembahasan.
Seperti yang dijelaskan pada pembahasan sola sebelumnya bahwa ikatan hidrogen terjadi pada senyawa HF, NH3 dan H2O (1,2 dan 3). Hal ini disebabkan karena selisih keelektronegatifan dalam ketiga atom (F, N dan O) dengan unsur H sangat besar karena ketiga atom tersebut memiliki harga keelektrongatifan paling besar dalam sistem periodik.
Soal 22
Diketahui persamaan reaksi termokimia sebagai berikut:
1). C(s) + O2(g) ==> CO2(g)
2.) H2(g) + 1/2O2(g) ==> H2O(g)
3.) 6C(s) + 3H2(g) ==> C6H6(g)
Berdasarkan reajsi tersebut perubahan entalpi pembakaran untuk C6H6 adalah . . . .?
Pembahasan
Ini adalah salah satu contoh soal menentukan perubahan entalpi dengan hukum Hess. Nah yang agak menantang disini adalah kita tidak diberikan reaksi yang akan kita cari perubahan entalpinya, sehingga menuntut kemahiran kita dalam membuat reaksinya.
Reaksi yang ditanya adalah reaksi pembakaran C6H6. Senyawa C6H6 adalah senyawa hidrokarbon yang apabila dibakar (direaksikan denan O2) akan menghasilkan CO2 dan H2O. Kemudian tinggal kita setarakan rekasinya.
Reaksi setaranya :
2C6H6(g) + 15O2(g) ==> 12CO2(g) + 6H2O(g)
Kita harus susun reaksi diatas sehinngga jika kita jumlahkan hasilnya adalah reaksi pembajaran C6H6.
Kita mulai dari C6H6. Reaksi yang diketahui memiliki C6H6 adalah reaksi ke-3, tetapi letaknya diproduk sementara untuk rekasi yang diminta adalah direaktan, maka rekasi tersebut dibalik.
C6H6 ==> 6C + 3H2
Kemudian C6H6 yang dibutuhkan pada reaksi yang diminta adalah 2 mol, maka koefisien reaksi yang telah dibalik diatas kita kali 2, termasuk harga
(1) 2C6H6 ==> 12C + 6H2
Langkah selanjutnya adalah mencari dari reaksi yang diketahui ada CO2 yaitu reaksi 1. Pada reaksi yang diminta cari perubahan entalpinya CO2 berada diproduk dan pada reaksi 1 posisi CO2 sudah ada di produk sehingga tidk usah kita ubah. CO2 yang ada pada reaksi yang diminta ada 12 mol, sehingga koefisien reaksi 1 harus dikali 12 dan juga harga
(2) 12C(s) + 12O2(g) ==> 12CO2(g)
Tinggal reaksi ke 2 yang belum disesuaikan dengan reaksi yang diminta. Kita sesuaikan dengan posisi H2O nya. Pada reaksi yang diminta dan rekasi 2 yang diketahui posisi H2O sudah sama sam berada di produk hanya molnya saja yang harus diubah. Pada reaksi yang diminta ada 6 mol H2O sehingga koefisien reaksi 2 harus dikali 6 termasuk harga
(3) 6H2(g) + 3O2(g) ==> 6H2O(g)
Langkah terakhir tinggal jumlahkan rekasi rekasi yang telah kita ubah yang hasilnya pasti sesuia dengan reaksi yang diminta dan jumlahkan juga harga
2C6H6 ==>
2C6H6(g) + 15O2(g) ==> 12CO2(g) + 6H2O(g)
Karena yang diminta adalah untuk kJ/mol, maka harga
Soal 23
Sebanyak 22,8 gram bahan bakar yang tidak dikenal (Mr = 114) dibakar sempurna. Panas yang dihasilkan dapat menaikkan suhu 100 mL air sebesar 10 derajat Celsius. Jika massa jenias air 1 g/mL dan cp air = 4,2 J/gr K, kaor pembakaran dari bahan bakar tersebut sebesar . . . .?
Pembahasan :
Ini adalah soal menghitung perubahan entalpi reaksi memalui percobaan kalorimeter.
massa larutan = 100 mL x 1 gr/mL = 100 gram
Kalor yang dilepas oleh reaksi pembakaran gas tak dikenal tersebut
= - q larutan
= - ( m c
= - (100 gram . 4,2 J/gr K . 10)
= - 4200 J
= - 4,2 kJ
Untuk 22,8 gram bahan bakar akan dihasilkan kalor sebanyak =
mol = gr/Mr = 22,8/114 = 0,2 mol
= - 21,00 kJ
Soal 24
Diketahui kalor pembentukan standar (
2MgO(s) + C(s) ==> 2Mg(s) + CO2(g) adalah . . . .kJ.
Pembahasan :
Jika kalian bisa memahami soal, ini adalah soal mencari harga perubahan entalpi menggunakan konsep huku Hess. Namun sulitnya adalah kita tidak diberi rekasi yang diketahui. Jadi ya terpaksa kita harus tulis reaksi itu.
Yang diketahui disoal kan kalor pembentukan standar MgO dan CO2, artinya zat tersebut akan dibuat sebanyak 1 mol dari unsur unsurnya. MgO terbuat dari Mg(s) dan O2(g) sedangkan CO2 terbuat dari C(s) dan O2(g), tinggal tulis reaksinya dan setarakan. Tapi ingat jangan pernah mengubah koefisien zat yang dibentuk karena yang diketahu kan kalor pada keadaan standar yaitu 1 mol zat.
Reaksi yang diketahui berdasarkan soal :
1. Mg(s) + 1/2O2(g) ==> MgO(s)
2. C(s) + O2(g) ==> CO2(g)
Reaksi yang diminta :
2MgO(s) + C(s) ==> 2Mg(s) + CO2(g)
Langkah pertama adalah mencari reaksi yang diketahui mengandung MgO yaitu rekasi pertama tetapi pada reaksi itu letak MgO nya diproduk sementara pada reaksi yang diminta ada dikanan. Reaksinya harus kita balik. Kemudian pada reaksi yang diminta koefisien reaksinya adalah 2, maka setelah dibalik semua koefisien reaksi pertama dikali 2 termasuk harga perubahan entalpinya.
Jadinya begini :
3. 2MgO(s) ==> 2Mg(s) + O2(g)
Langkah kedua adalah menyesuaikan reaksi ke-2 agar ketika dijumlahkan dengan reaksi 3 jadinya adalah reaksi yang diminta. Dari reaksi ke 2 yang kita butuhkan adalah C nya dimana sudah sama sama letaknya direaktan dan koefisiennya 1 mol. Jadi tidak usah diubah.
4. C(s) + O2(g) ==> CO2(g)
Langkah terakhir jumlahkan reaksi 3 dan 4
2MgO(s) ==> 2Mg(s) + O2(g)
C(s) + O2(g) ==> CO2(g)
2MgO(s) + C(s) ==> 2Mg(s) + CO2(g)
Nah cara diatas kalian gunakan jika soalnya Essay. Tapi jika soalnya obejktif, ngak nusah kayak diatas. Kalian perhatikan saja perubahan entalpinya.
Misalkan reaksi pertama kan MgOnya dibalik jadi
Kemudian pada reaksi kedua kan yang dibutuhkan C dan tidak dibalik dan tidak diubah koefieinnya. Maka harga
Nah tinggal jumlahin hasilnya pasti sama..
Nah itulah tadi telah diuraikan mengenai Soal Ujian Akhir Semester Ganjil Kelas XI. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
Loading...










