Selamat Datang kembali di blog freemathlearn. Blog yang membahas seputar matematika dan ilmu sains lainnya. Baiklah untuk kali ini akan kita bahas mengenai
Hubungan pH, pOH dan pKw. Silakan disimak ya guys!
>
![K_{w} = [H^{+}][OH^{-}]](https://latex.codecogs.com/gif.latex?K_{w}&space;=&space;[H^{+}][OH^{-}])
Hasil kali konsentrasi H+ dan OH- inilah yang disebut dengan konstanta kesetimbangan air, disimbolkan dengan Kw.
Hubungan H+dengan OH-
Pada suhu kamar (25 derajat Celsius) konsntanta kesetimbangan air Kw =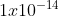 .
.
Dalam air murni, pH air selalu 7. Artinya kosentrasi H+ dan OH- dalam larutan adalah selalu sama.
[H+] = [OH-] = x
[H+][OH-] = Kw
(x) (x) =Kw
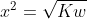
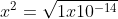
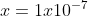
Artinya konsentrasi H+ dan OH- dalam larutan netral = 1 x 10^-7 M.
Jika dalam air ditambahkan zat asam, maka jumlah ion H+ akan semakin banyak sehingga larutan akan bersifat asam. Tetapi harga konstanta kesetimbangan atau hasil kali ion H+ dan OH- akan selalu tetap karena kesetimbangan akan bergeser kekiri. Pergeseran kesetimbangan ini akan membuat konsentrasi ion OH- berkurang. Begitu juga sebaliknya jika ditambah basa.
Artinya:
Kw = [H+][OH-]
Jika larutan netral: [H+] = [OH-]
Jika larutan asam :[H+] > [OH-]
Jika larutan basa : [H+] < [OH-]
Contoh:
Berapa konsentrasi ion H+ dalam larutan yang konsentrasi ion OH- nya = 0,025
Jawab :
[H+][OH-] = Kw
[H+] = Kw/[OH-]
= 1 x 10^-14/2,5 x 10^-2
= 4 x 10^-13 M
Hubungan pH dengan pOH
Kw = [H+][OH-] , Kemudian logaritmaka kedua ruas
- log Kw = - log ([H+][OH-] )
- log Kw = - log [H+] + [- log OH-]
pKw = pH + pOH
pH ditambah pOH adalah pKw. Pada suhu kamar kan diketahui Kw = 1 x 10^-14, maka:
pH + pOH = pKw
= - log Kw
= -log (1 x 10^-14)
= 14
Jadi harga pH maksimum pada suhu kamar adalah 14.
Jika Asam =pH <7
Jika Basa = pH > 7
Kemabli pada soal pertama tadi. Jika diketahui pOHnya = 3, maka pH = 14 - pOH = 14-3 = 11. Karenanya pHnya 11 larutan akan bersifat basa..
Nah itulah tadi telah diuraikan mengenai Hubungan pH, pOH dan pKw. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
>
pOH
Jika pH bergantung pada konsentrasi H+, maka pOH nilainya bergantung pada konsentrasi OH- dalam larutan. Secara matematika dirumuskan sebagai berikut :
pOH = - log [OH-]
Contoh.
Jika suatu larutan mengandung konsentrasi ion OH- dalam larutan adalah 0,001 M.
Maka pOH = - log [OH-]
= - log 0,001
= - log 1 x 10^-3
= 3
Sebalikknya jika diketahui pOH sama dengan 2 misalnya, maka konsentrasi OH- dalam larutan tersebut adalah:
= 10^-pOH
= 10^-2 = 1 x 10^-2
Nah intinya rumus pOH dan pH adalah sama. Hanya tinggal mengganti konsentrasi H+ untuk mencari pH dan OH- untuk mencari pOH.
Jika larutannya asam, maka nilai pH < 7 sedangkan jika larutannya basa maka pH > 7. Untukcontoh diatas kan larutan yang dicari adalah basa tapi pOH nya 2. Nanti di bagian akhir akan dijelaskan hubungn pH dan pOH sehingga konsep pH asam dan basa akan lebih jelas.
Tetapan Kesetimbangan Air (Kw)
Tahukah kalian sebenarnya air dalam gelas yang sering kita minum itu berada dalam reaksi kesetimbangan?
Sebagai buktinya adalah air dapat menghantarkan arrus listrik walaupun sangat buruk. Salah satu penyebabnya adalah bahwa air mengalami ionisasi menjadi ion H+ dan OH-. Reaksi ionisasi air ini berada dalam kesetimbangan dengan laju reaksi pengionan sama dengan pembentukan air. Sehingga seolah olah kita tidak melihat bahwa air itu mengion.
Reaksi ionisasi air.
H2O(l) <==> H+(aq) + OH-(aq)
Berdasarkan reaksi tersebut tentu kita bisa membuat konstanta kesetimbangannya sebagai berikut :
![K = \frac{[H^{+}][OH^{-}]}{[H_{2}O]}](https://latex.codecogs.com/gif.latex?K&space;=&space;\frac{[H^{+}][OH^{-}]}{[H_{2}O]})
Karena H2O dalam reksi diatas berwujid l (liquid), maka konsentrasinya akan selalu tetap sehingga dianggap konstan dan tidak mempengaruhi konsntanta kesetimbangan. Konstanta kesetimbangannya menjadi:
Jika pH bergantung pada konsentrasi H+, maka pOH nilainya bergantung pada konsentrasi OH- dalam larutan. Secara matematika dirumuskan sebagai berikut :
pOH = - log [OH-]
Contoh.
Jika suatu larutan mengandung konsentrasi ion OH- dalam larutan adalah 0,001 M.
Maka pOH = - log [OH-]
= - log 0,001
= - log 1 x 10^-3
= 3
Sebalikknya jika diketahui pOH sama dengan 2 misalnya, maka konsentrasi OH- dalam larutan tersebut adalah:
= 10^-pOH
= 10^-2 = 1 x 10^-2
Nah intinya rumus pOH dan pH adalah sama. Hanya tinggal mengganti konsentrasi H+ untuk mencari pH dan OH- untuk mencari pOH.
Jika larutannya asam, maka nilai pH < 7 sedangkan jika larutannya basa maka pH > 7. Untukcontoh diatas kan larutan yang dicari adalah basa tapi pOH nya 2. Nanti di bagian akhir akan dijelaskan hubungn pH dan pOH sehingga konsep pH asam dan basa akan lebih jelas.
Tetapan Kesetimbangan Air (Kw)
Tahukah kalian sebenarnya air dalam gelas yang sering kita minum itu berada dalam reaksi kesetimbangan?
Sebagai buktinya adalah air dapat menghantarkan arrus listrik walaupun sangat buruk. Salah satu penyebabnya adalah bahwa air mengalami ionisasi menjadi ion H+ dan OH-. Reaksi ionisasi air ini berada dalam kesetimbangan dengan laju reaksi pengionan sama dengan pembentukan air. Sehingga seolah olah kita tidak melihat bahwa air itu mengion.
Reaksi ionisasi air.
H2O(l) <==> H+(aq) + OH-(aq)
Berdasarkan reaksi tersebut tentu kita bisa membuat konstanta kesetimbangannya sebagai berikut :
Karena H2O dalam reksi diatas berwujid l (liquid), maka konsentrasinya akan selalu tetap sehingga dianggap konstan dan tidak mempengaruhi konsntanta kesetimbangan. Konstanta kesetimbangannya menjadi:
Loading...
Hasil kali konsentrasi H+ dan OH- inilah yang disebut dengan konstanta kesetimbangan air, disimbolkan dengan Kw.
Hubungan H+dengan OH-
Pada suhu kamar (25 derajat Celsius) konsntanta kesetimbangan air Kw =
Dalam air murni, pH air selalu 7. Artinya kosentrasi H+ dan OH- dalam larutan adalah selalu sama.
[H+] = [OH-] = x
[H+][OH-] = Kw
(x) (x) =Kw
Artinya konsentrasi H+ dan OH- dalam larutan netral = 1 x 10^-7 M.
Jika dalam air ditambahkan zat asam, maka jumlah ion H+ akan semakin banyak sehingga larutan akan bersifat asam. Tetapi harga konstanta kesetimbangan atau hasil kali ion H+ dan OH- akan selalu tetap karena kesetimbangan akan bergeser kekiri. Pergeseran kesetimbangan ini akan membuat konsentrasi ion OH- berkurang. Begitu juga sebaliknya jika ditambah basa.
Artinya:
Kw = [H+][OH-]
Jika larutan netral: [H+] = [OH-]
Jika larutan asam :[H+] > [OH-]
Jika larutan basa : [H+] < [OH-]
Contoh:
Berapa konsentrasi ion H+ dalam larutan yang konsentrasi ion OH- nya = 0,025
Jawab :
[H+][OH-] = Kw
[H+] = Kw/[OH-]
= 1 x 10^-14/2,5 x 10^-2
= 4 x 10^-13 M
Hubungan pH dengan pOH
Kw = [H+][OH-] , Kemudian logaritmaka kedua ruas
- log Kw = - log ([H+][OH-] )
- log Kw = - log [H+] + [- log OH-]
pKw = pH + pOH
pH ditambah pOH adalah pKw. Pada suhu kamar kan diketahui Kw = 1 x 10^-14, maka:
pH + pOH = pKw
= - log Kw
= -log (1 x 10^-14)
= 14
Jadi harga pH maksimum pada suhu kamar adalah 14.
Jika Asam =pH <7
Jika Basa = pH > 7
Kemabli pada soal pertama tadi. Jika diketahui pOHnya = 3, maka pH = 14 - pOH = 14-3 = 11. Karenanya pHnya 11 larutan akan bersifat basa..
Nah itulah tadi telah diuraikan mengenai Hubungan pH, pOH dan pKw. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
Loading...





