Selamat Datang kembali di blog freemathlearn. Blog yang membahas seputar matematika dan ilmu sains lainnya. Baiklah untuk kali ini akan kita bahas mengenai
Soal dan Pembahasan tentang Konfigurasi Elektron. Silakan disimak ya guys!
>
Nah itulah tadi telah diuraikan mengenai Soal dan Pembahasan tentang Konfigurasi Elektron. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
>
Menentukan Konfigurasi Atom yang Benar
Soal 1
Konfigurasi elektron yang tepat untuk atom Cu dengan nomor atom 29 adalah . . . .
A.![[Ar]3d^{9}4s^{2}](https://latex.codecogs.com/gif.latex?[Ar]3d^{9}4s^{2})
B.![[Ar]3d^{10}4s^{1}](https://latex.codecogs.com/gif.latex?[Ar]3d^{10}4s^{1})
C.![[Ar]4d^{9}5s^{1}](https://latex.codecogs.com/gif.latex?[Ar]4d^{9}5s^{1})
D.![[Ar]4d^{9}5s^{2}](https://latex.codecogs.com/gif.latex?[Ar]4d^{9}5s^{2})
E.![[Ar]4d^{10}5s^{1}](https://latex.codecogs.com/gif.latex?[Ar]4d^{10}5s^{1})
Pembahasan :
Cu memiliki nomor atom 29, artinya Cu memiliki 29 elektron.
Konfigurasi elektron Cu

Perhatikan kulit valensinya yaitu
Ingat!!
Konfigurasi elektron yang stabil adalah yang orbitalnya terisi penuh atau setengah penuh elektron.
Pada kulit valensi atom Cu diatas, subkulit 4s-nya penuh terisi oleh elektron sedangkan subkulit 3d-nya tidak penuh ataupun setengah penuh ( subkuit d itu maksimum diisi oleh 10 elektron, setengah penuhnya adalah 5 elektron). Jadi konfigurasi ini kurang stabil, sehingga atom akan mengeksitasi(mentransfer) satu buah elektron dari subkulit 4s ke subkulit 3d, sehingga konfigurasi elektronnya menjadi:

Subkulit 4s-nya setengah penuh, sedangkan sub kulit 3d-nya penuh terisi oleh elektron. Hal ini lebih disukai oleh elektron karena bersifat lebih stabil.
Karena konfigurasi elektron diatas agak panjang, biasanya kita akan enyingkan dengan menggunakan konfigurasi atom golongan gas mulia. Untuk atom Cu, atom gas mulia yang mengdekati adalah Ar dengan nomor atom 18, sehingga konfigurasi elektronnya menjadi :
![[Ar]4s^{1}3d^{10}](https://latex.codecogs.com/gif.latex?[Ar]4s^{1}3d^{10}) atau
atau ![[Ar]3d^{10}4s^{1}](https://latex.codecogs.com/gif.latex?[Ar]3d^{10}4s^{1})
Jawaban : B
Menentukan Jumlah Orbital dan jumlah Maksimum Elektron di Setiap Subkulit
Soal 2
Pernyataan yang benar tentang jumlah orbital dalam subkulit adalah . . . .
A. Jumlah orbital subkulit s = 2
B. Jumlah orbital subkulit d = 5
C. Jumlah orbital subkulit f = 8
D. Jumlah orbital subkulit g = 10
E. Jumlah orbital subkulit h = 14
Pembahasan :
Sub kulit s memiliki nilai bilangan kuantum azimuth (l) = 0, sehingga nilai bilangan kuantum magnetiknya hanya satu yaitu 0 ( karena nilai m adalah dari -l, 0 sampai +l).
Jika hanya punya satu nilai m, maka orbitalnya juga cuma satu ( dilambangkan dengan satu kotak). Kita ketahui bahwa jumlah maksimum elektron dalam satu orbital (satu kotak) hanya muat dua elektron, sehingga jumlah maksimum elektron di subkulit s adalah 2 buah elektron.
Dengan metode yang sama akan didapatkan ringkasan sebagai berikut :
Jawaban : B
Menentukan Urutan Pengisian Elektron pada Subkulit
Soal 3
Urutan penempatan elektro dari tingkat energi terendah yang benar adalah . . . .
A. 1s 2s 2p 3s 3p 3d 4s 4p 4d
B. 1s 2s 2p 3s 3p 4s 3d 4p 4d
C. 1s 2s 2p 3s 3p 4s 3d 4p 5s
D. 1s 2s 2p 3s 3p 3d 4s 4p 5s
E. 1s 2s 2p 3s 3p 4s 4d 4p 5s
Pembahasan:
Untuk menentukan urutan pengisian elektron dalam atom, kita harus mematuhi aturan Hund yaitu pengisian elektron dimulai dari orbital dengan tingkat energi paling rendah ke tingkat yang lebih tinggi sesuai dengan urutan berikut :
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p dan seterusnya. Ikuti saja arah anak panah.
Jawaban : C
Aturan Pengisian Elektron
Soal 4
Pernyatan bahwa elektron akan menempati subkulit yang energinya paling rendah kemudian bertahap ke tingkat energi yang lebih tinggi, merupakan prinsip dari kaidah . . . .
A. Aufbau
B. Heisenberg
C. Max Planck
D. Schrodinger
E. Wolfgang Pauli
Pembahasan:
Aufbau
pengisian elektron dimulai dari subkulit berenergi rendah sampai penuh, baru kemudian mengisi subkulit yang energinya lebih tinggi.
Aturan Hund
Pada pengisian orbital orbital suatu subkulit, elektron akan mengisi orbital dengan spin yang paralel terlebih dahulu, baru kemudian mengisi orbital dengan spin yang berbeda.
Azas Larangan Pauli
Tidak boleh ada dua elektron dalam sebuah atom yang memiliki empat nilai bilangan kuantum yang sama. Hal ini juga sesuai dengan arah perputaran elektron yang tidak boleh sama, melainkan harus berlawanan sehingga bilangan kuantum spinnya berbeda walaupun ketiga bilangan kuantum lainnya sama.
Menentukan konfigurasi elektron dari ion positif atau ion negatif
Soal 5
Jika diketahui Fe memiliki nomor atom 26 dan massa atomnya adalah 56, konfigurasi elektron dari ion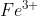 adalah . . . .
adalah . . . .
A.![[Ar]4s^{2}3d^{8}](https://latex.codecogs.com/gif.latex?[Ar]4s^{2}3d^{8})
B.![[Ar]4s^{2}3d^{3}](https://latex.codecogs.com/gif.latex?[Ar]4s^{2}3d^{3})
C.![[Ar]4s^{1}3d^{9}](https://latex.codecogs.com/gif.latex?[Ar]4s^{1}3d^{9})
D.![[Ar]3d^{8}](https://latex.codecogs.com/gif.latex?[Ar]3d^{8})
E.![[Ar]3d^{5}](https://latex.codecogs.com/gif.latex?[Ar]3d^{5})
Pembahasan:
Fe nomor atomnya = 26 dan nomor massanya = 56. Berarti atom Fe mempunyai 26 elektron.
Konfigurasi elektron Fe
![[Ar]4s^{2}3d^{6}](https://latex.codecogs.com/gif.latex?[Ar]4s^{2}3d^{6})
Jika mebentuk ion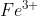 , artinya atom Fe melepas 3 buah elektronnya, sehingga jumlah elektron ion
, artinya atom Fe melepas 3 buah elektronnya, sehingga jumlah elektron ion 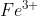 menjadi = 26 - 3 = 23
menjadi = 26 - 3 = 23
Elektron dari sub kulit mana yang akan dibuang terlebih dahulu?? Apakah 4s atau 3d??
Soal 1
Konfigurasi elektron yang tepat untuk atom Cu dengan nomor atom 29 adalah . . . .
A.
B.
C.
D.
E.
Pembahasan :
Cu memiliki nomor atom 29, artinya Cu memiliki 29 elektron.
Konfigurasi elektron Cu
Perhatikan kulit valensinya yaitu
Ingat!!
Konfigurasi elektron yang stabil adalah yang orbitalnya terisi penuh atau setengah penuh elektron.
Pada kulit valensi atom Cu diatas, subkulit 4s-nya penuh terisi oleh elektron sedangkan subkulit 3d-nya tidak penuh ataupun setengah penuh ( subkuit d itu maksimum diisi oleh 10 elektron, setengah penuhnya adalah 5 elektron). Jadi konfigurasi ini kurang stabil, sehingga atom akan mengeksitasi(mentransfer) satu buah elektron dari subkulit 4s ke subkulit 3d, sehingga konfigurasi elektronnya menjadi:
Subkulit 4s-nya setengah penuh, sedangkan sub kulit 3d-nya penuh terisi oleh elektron. Hal ini lebih disukai oleh elektron karena bersifat lebih stabil.
Karena konfigurasi elektron diatas agak panjang, biasanya kita akan enyingkan dengan menggunakan konfigurasi atom golongan gas mulia. Untuk atom Cu, atom gas mulia yang mengdekati adalah Ar dengan nomor atom 18, sehingga konfigurasi elektronnya menjadi :
Jawaban : B
Menentukan Jumlah Orbital dan jumlah Maksimum Elektron di Setiap Subkulit
Soal 2
Pernyataan yang benar tentang jumlah orbital dalam subkulit adalah . . . .
A. Jumlah orbital subkulit s = 2
B. Jumlah orbital subkulit d = 5
C. Jumlah orbital subkulit f = 8
D. Jumlah orbital subkulit g = 10
E. Jumlah orbital subkulit h = 14
Pembahasan :
Sub kulit s memiliki nilai bilangan kuantum azimuth (l) = 0, sehingga nilai bilangan kuantum magnetiknya hanya satu yaitu 0 ( karena nilai m adalah dari -l, 0 sampai +l).
Jika hanya punya satu nilai m, maka orbitalnya juga cuma satu ( dilambangkan dengan satu kotak). Kita ketahui bahwa jumlah maksimum elektron dalam satu orbital (satu kotak) hanya muat dua elektron, sehingga jumlah maksimum elektron di subkulit s adalah 2 buah elektron.
Dengan metode yang sama akan didapatkan ringkasan sebagai berikut :
Jawaban : B
Menentukan Urutan Pengisian Elektron pada Subkulit
Soal 3
Urutan penempatan elektro dari tingkat energi terendah yang benar adalah . . . .
A. 1s 2s 2p 3s 3p 3d 4s 4p 4d
B. 1s 2s 2p 3s 3p 4s 3d 4p 4d
C. 1s 2s 2p 3s 3p 4s 3d 4p 5s
D. 1s 2s 2p 3s 3p 3d 4s 4p 5s
E. 1s 2s 2p 3s 3p 4s 4d 4p 5s
Pembahasan:
Untuk menentukan urutan pengisian elektron dalam atom, kita harus mematuhi aturan Hund yaitu pengisian elektron dimulai dari orbital dengan tingkat energi paling rendah ke tingkat yang lebih tinggi sesuai dengan urutan berikut :
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p dan seterusnya. Ikuti saja arah anak panah.
Jawaban : C
Aturan Pengisian Elektron
Soal 4
Pernyatan bahwa elektron akan menempati subkulit yang energinya paling rendah kemudian bertahap ke tingkat energi yang lebih tinggi, merupakan prinsip dari kaidah . . . .
A. Aufbau
B. Heisenberg
C. Max Planck
D. Schrodinger
E. Wolfgang Pauli
Pembahasan:
Aufbau
pengisian elektron dimulai dari subkulit berenergi rendah sampai penuh, baru kemudian mengisi subkulit yang energinya lebih tinggi.
Aturan Hund
Pada pengisian orbital orbital suatu subkulit, elektron akan mengisi orbital dengan spin yang paralel terlebih dahulu, baru kemudian mengisi orbital dengan spin yang berbeda.
Azas Larangan Pauli
Tidak boleh ada dua elektron dalam sebuah atom yang memiliki empat nilai bilangan kuantum yang sama. Hal ini juga sesuai dengan arah perputaran elektron yang tidak boleh sama, melainkan harus berlawanan sehingga bilangan kuantum spinnya berbeda walaupun ketiga bilangan kuantum lainnya sama.
Menentukan konfigurasi elektron dari ion positif atau ion negatif
Soal 5
Jika diketahui Fe memiliki nomor atom 26 dan massa atomnya adalah 56, konfigurasi elektron dari ion
A.
B.
C.
D.
E.
Pembahasan:
Fe nomor atomnya = 26 dan nomor massanya = 56. Berarti atom Fe mempunyai 26 elektron.
Konfigurasi elektron Fe
Jika mebentuk ion
Elektron dari sub kulit mana yang akan dibuang terlebih dahulu?? Apakah 4s atau 3d??
Loading...
Untuk menjawabnya kita harus ingat kembali konsep bahwa elektron yang mudah lepas adalah elektron yang berada pada kulit paling luar (lihat harga bilangan kuantum utamanya (n)) . Hal ini disebabkan gaya tarik inti terhadap elektron tersebut akan semakin kecil. Subkulit 4s harga n-nya adalah 4 sedangkan subkulit 3d harga n-nya adalah 3, sehingga elektron yang keluar terlebih dahulu adalah yang berada di subkulit 4s baru kemudian 3d.
Konfigurasi elektron ion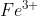 menjadi :
menjadi :
![[Ar]4s^{0}3d^{5}](https://latex.codecogs.com/gif.latex?[Ar]4s^{0}3d^{5}) atau
atau ![[Ar]3d^{5}](https://latex.codecogs.com/gif.latex?[Ar]3d^{5})
Jawaban : E
Menentukan Kulit dan jumlah elektron Valensi Suatu Atom
Soal 6
Kulit valensi dan jumlah elektron valensi yang terdapat pada atom 23V adalah . . . .
A. Kulit valensi 3d dan jumlah elektron valensi 3
B. Kulit valensi 3d dan jumlah elektron valensi 5
C. Kulit valensi 3d, 4s dan jumlah elektron valensi 3
D. Kulit valensi 3d, 4s dan jumlah elektron valensi 5
E. Kulit valensi 3d, 4s dan jumlah elektron valensi 7
Pembahasan :
Atom V dengan nomor atom 23 memiliki konfigurasi elektron :

Formula Summary
Untuk menentukan Kulit valensi lihat saja ujung konfigurasi elektronnnya :\
Menentukan Nomor Atom Suatu Unsur Jika Diketahui Konfigurasi Ionnnya
Soal 7
Ion mempunyai konfigurasi elektron
mempunyai konfigurasi elektron  . Nomor atom A adalah . . . .
. Nomor atom A adalah . . . .
A. 52
B. 54
C. 56
D. 58
E. 60
Pembahasan :
Konfigurasi ion adalah :
adalah :

Jumlah elektron ion = 54
= 54
Ion terbentuk ketika atom A menerima 2 buah elektron sehingga jumlah elektron atom A mula - mula adalah = 54 - 2 = 52
terbentuk ketika atom A menerima 2 buah elektron sehingga jumlah elektron atom A mula - mula adalah = 54 - 2 = 52
Jumlah elektron = Nomor atom = 52
Jawaban : A
Soal 8
Jika konfigurasi elektron ion adalah
adalah  , nomor atom B adalah . . . .
, nomor atom B adalah . . . .
A. 28
B. 30
C. 32
D. 34
E. 36
Pembahasan :
Konfigurasi elektron ion adalah :
adalah :

Jumlah elektron ion = 30
= 30
ion terbentuk ketika atom B melepas 2 buah elektronnya, sehingga jumlah elektron atom B mula - mula adalah = 30 + 2 = 32
terbentuk ketika atom B melepas 2 buah elektronnya, sehingga jumlah elektron atom B mula - mula adalah = 30 + 2 = 32
Jawaban: C
Menentukan jumlah orbital yang terisi penuh oleh elektron
Soal 9
Unsur 35Br memiliki orbital yang terisi penuh sebanya . . . . .orbital
A. 3
B. 8
C. 15
D. 17
E. 18
Pembahasan :
Konfigurasi elektron Br dengan nomor atom 35 :
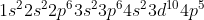
Ingat !!
Subkulit s penuh terisi 2 elektron dengan 1 orbital
Subkulit p penuh terisi 6 elektron dengan 3 orbital
Subkulit d penuh terisi 10 elektron dengan 5 orbital
Subkulit f penuh terisi 15 elektron dengan 7 orbital
Kita lihat ada 4 subkulit s yang terisi penuh oleh elektron yaitu , sehingga jumlah orbitalnya ada 4
, sehingga jumlah orbitalnya ada 4
Subkulit p yang terisi penuh ada 2 yaitu (3 orbital) dan
(3 orbital) dan  (3 orbital), sedangkan untuk
(3 orbital), sedangkan untuk 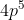 tidak terisi penuh elektron. Untuk mengetahui jumlah orbital yang terisi penuh oleh elektron pada subkulit maka kita perlu menggambar diagram orbitalnya, yaitu :
tidak terisi penuh elektron. Untuk mengetahui jumlah orbital yang terisi penuh oleh elektron pada subkulit maka kita perlu menggambar diagram orbitalnya, yaitu :
Dari diagram orbital diatas kita bisa melihat bahwa hanya 2 buah orbital daja dari subkulit 4p yang diisi penuh oleh elektron.
Sehingga jumlah orbital sub kulit p ada = 3 + 3 + 2 = 8
Sub kulit d yang terisi penuh oleh elektron hanya satu yaitu , sehingga banyaknya orbital ada 5 buah.
, sehingga banyaknya orbital ada 5 buah.
Jadi, total orbital yang terisi penuh oleh elektron
= 4 + 8 + 5 = 17 orbital
Jawaban : D.
Konfigurasi elektron ion
Jawaban : E
Menentukan Kulit dan jumlah elektron Valensi Suatu Atom
Soal 6
Kulit valensi dan jumlah elektron valensi yang terdapat pada atom 23V adalah . . . .
A. Kulit valensi 3d dan jumlah elektron valensi 3
B. Kulit valensi 3d dan jumlah elektron valensi 5
C. Kulit valensi 3d, 4s dan jumlah elektron valensi 3
D. Kulit valensi 3d, 4s dan jumlah elektron valensi 5
E. Kulit valensi 3d, 4s dan jumlah elektron valensi 7
Pembahasan :
Atom V dengan nomor atom 23 memiliki konfigurasi elektron :
Formula Summary
Untuk menentukan Kulit valensi lihat saja ujung konfigurasi elektronnnya :\
- Jika berakhir di subkulit s, maka kulit valensinya adalah
, dengan x adalah elektron valensinya.
- Jika berakhir di subkulit p, maka kulit valensinya adalah
, dengan x + y adalah elektron valensi. Harga n untuk subkukit s dan p nya sama, misalnya : 3s 3p, 4s 4p dan seterusnya.
- Jika berakhir di subkukit d, maka kulit valensinya adalah
dengan x + y adalah jumlah elektron valensi. Harga n untuk s lebih tinggi satu tingkat dibandingkan dengan d. Misalnya : 4s 3d, 5s 4d dan sebagainya.
Nah untuk soal diatas, ujung konfigurasinya adalah 3d, maka pasangannnya adalah subkulit s yang harga n-nya satu tingkat lebih tinggi dibandingkan dengannya yaitu 4s
Jumlah elektron valensi = 2 + 3 = 5
Jawaban : D
Soal 7
Ion
A. 52
B. 54
C. 56
D. 58
E. 60
Pembahasan :
Konfigurasi ion
Jumlah elektron ion
Ion
Jumlah elektron = Nomor atom = 52
Jawaban : A
Soal 8
Jika konfigurasi elektron ion
A. 28
B. 30
C. 32
D. 34
E. 36
Pembahasan :
Konfigurasi elektron ion
Jumlah elektron ion
ion
Jawaban: C
Menentukan jumlah orbital yang terisi penuh oleh elektron
Soal 9
Unsur 35Br memiliki orbital yang terisi penuh sebanya . . . . .orbital
A. 3
B. 8
C. 15
D. 17
E. 18
Pembahasan :
Konfigurasi elektron Br dengan nomor atom 35 :
Ingat !!
Subkulit s penuh terisi 2 elektron dengan 1 orbital
Subkulit p penuh terisi 6 elektron dengan 3 orbital
Subkulit d penuh terisi 10 elektron dengan 5 orbital
Subkulit f penuh terisi 15 elektron dengan 7 orbital
Kita lihat ada 4 subkulit s yang terisi penuh oleh elektron yaitu
Subkulit p yang terisi penuh ada 2 yaitu
Dari diagram orbital diatas kita bisa melihat bahwa hanya 2 buah orbital daja dari subkulit 4p yang diisi penuh oleh elektron.
Sehingga jumlah orbital sub kulit p ada = 3 + 3 + 2 = 8
Sub kulit d yang terisi penuh oleh elektron hanya satu yaitu
Jadi, total orbital yang terisi penuh oleh elektron
= 4 + 8 + 5 = 17 orbital
Jawaban : D.
Nah itulah tadi telah diuraikan mengenai Soal dan Pembahasan tentang Konfigurasi Elektron. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
Loading...







