Selamat Datang kembali di blog freemathlearn. Blog yang membahas seputar matematika dan ilmu sains lainnya. Baiklah untuk kali ini akan kita bahas mengenai
Soal dan Pembahasan tentang Bilangan Kuantum Kelas 10 SMA. Silakan disimak ya guys!
>
Nah itulah tadi telah diuraikan mengenai Soal dan Pembahasan tentang Bilangan Kuantum Kelas 10 SMA. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
>
Menentukan Pengertian, Fungsi dan Nilai Bilangan Kuantum
Soal 1
Bilangan yang menyatakan pada tingkat energi mana suatu elektron terdapat adalah . . . . .
A. Bilangan kuantum
B. Bilangan kuantum utama
C. Bilangan kuantum azimuth
D. Bilangan kuantum magnetik
E. Bilangan kuantum spin
Pembahasan :
Bilangan kuantum ada 4 macam
Bilangan kuantum utama (n)
Nilai = 1, 2, 3, 4 .....dan seterusnya
Kegunaan = Menentukan tingkat energi atau kulit suatu elektron berada.
Jika:
n = 1 Kulit K
Kulit K  tingkat energi 1
tingkat energi 1
n = 2 Kulit L
Kulit L  tingkat energi 2
tingkat energi 2
n = 3 Kulit M
Kulit M  tingkat energi 3
tingkat energi 3
Dan seterusnya.
Bilangan kuantum azimuth (l)
Nilai = 0, 1, 2 .......sampai (n-1)
Jika:
n = 1 l = 0
l = 0
n = 2 l = 0, 1
l = 0, 1
n = 3 l = 0, 1, 2
l = 0, 1, 2
Dan seterusnya.
Kegunaan = Menyatakan di subkulit mana elektron berada
Jika:
l = 0 subkulit s
subkulit s
l = 1 subkulit p
subkulit p
l = 2 subkulit d
subkulit d
l = 3 subkulit f
subkulit f
Dan seterusnya.
Bilangan kuantum magnetik (m)
Nilai = - l, 0, +l
Kegunaan = Menyatakan di orbital mana elektron berada
Jika:
l = 0 m = 0 1
m = 0 1 orbital
orbital
l = 1 m = -1, 0, +1
m = -1, 0, +1 3 orbital
3 orbital
l = 2 m = -2, -2, 0, +1, +2
m = -2, -2, 0, +1, +2 5 orbital
5 orbital
Dan seterusnya.
Bilangan Kuantum Spin(s)
Nilai = +1/2 dan -1/2
Kegunaan = Menyatakan arah perputaran elektron
Jika arah panahnya keatas = +1/2
Jika arah panahnya kebawah = -1/2
Jawaban : B
Soal 2
Bilangan kuantum azimuth (l) yang masih dimungkinkan untuk l = 4 adalah . . . .
A. 1, 2, 3
B. 0, 1, 2, 3
C. 1, 2, 3, 4,
D. 0, 1, 2, 3, 4
E. Tidak bergantung pada harga n
Pembahasan :
Jika n = 4, maka :
Harga l = 0, .....(n-1) = 0, 1, 2, 3
Jawaban : B
Soal 3
Bilangan kuantum magnetik (m) = -3 dimiliki oleh elktron dari atom yang memiliki kulit elektron minimal sebanyak. . . .
A. 2
B. 3
C. 4
D. 5
D. 6
Pembahasan :
Jika memiliki m = -3, artinya nilai bilangan kuantum azimuth elektron dalam atom itu minimal adalah 3 karena nilai m itu bergantung pada harga l ( jika l = 3, maka harga m -nya = -3, -2, -1, 0, +1, +2, +3).
Untuk l = 3, maka minimal sebuah atom harus memiliki harga bilangan kuantum utama (n) adalah 4 karena nilai l itu dimulai dari 0, 1, ......sampai (n-1). Jadi jika n = 4, maka harga l = 0, 1, 2, 3.
Pada pembahasan soal no satu diatas sudah djelaskan bahwa bilangan kuantum utama menyatakan kulit atom. n = 4 artinya elektron berada pada tingkat energi ke empat atau kulit keempat (kulit N). Jadi agar suatu elektron memiliki nilai bilangan kuantum magnetik (m ) = - 3, maka atom itu harus memiliki setidaknya 4 buah kulit atom.
Jawaban : C
Menentukan Kemungkinan harga keempat bilangan kuantum yang mengisi suatu subkulit
Soal 4
Diantara harga keempat bilangan kuantum di bawah ini yang mungkin untuk pengisian elektron pada orbital 3p adalah . . . . .
A. n = 3, l = 2, m = -1, s = +1/2
B. n = 3, l = 1, m = -1, s = +1/2
C. n = 3, l = 2, m = +1, s = +1/2
D. n = 3, l = 2, m = 0, s = +1/2
E. n = 3, l = 2, m = +2, s = +1/2
Pembahasan :
Dari orbital 3p kita dapatkan :
Harga n = 3
Harga l = 1 (karena sub kulitnya adalah p)
Jika l = 1, maka harga m yang mungkin adalah -1, 0, +1
Harga s yang mungkin hanya dua yaitu +1/2 dan -1/2
Jadi kemungkina nilai keempat bilangan kuantum suatu elektron yang menempati subkulit/ orbital 3p adalah :
n = 3, l = 1, m = -1, 0, +1 dan s = +1/2 atau -1/2
Jawaban : B
Menentukan nilai bilangan kuantum suatu elektron dalam atom yang tidak diizinkan
Soal 5
Elektron yang memiliki bilangan kuantum yang tidak diizinkan adalah . . . . .
A. n = 3, l = 0, m = 0, s = - 1/2
B. n = 3, l = 1, m = 1, s = + 1/2
C. n = 3, l = 2, m = -1, s = + 1/2
D. n = 3, l = 1, m = 2, s = - 1/2
E. n = 3, l = 1, m = 2, s = + 1/2
Pembahasan :
Kita lihat optionnya, biasanya soal soal seperti ini punya ciri ciri yang sama yaitu harga n-nya sama untuk semua option, sehingga kita tidak perlu mengecek satu per-satu. Kalau berbeda?? ya...berarti harus di cek satu persatu ....
Pada option soal diatas nilai n = 3, maka:
Harga l = 0, 1, 2
Untuk l = 0 m = 0
m = 0
Untuk l = 1 m = -1, 0, +1
m = -1, 0, +1
Soal 1
Bilangan yang menyatakan pada tingkat energi mana suatu elektron terdapat adalah . . . . .
A. Bilangan kuantum
B. Bilangan kuantum utama
C. Bilangan kuantum azimuth
D. Bilangan kuantum magnetik
E. Bilangan kuantum spin
Pembahasan :
Bilangan kuantum ada 4 macam
Bilangan kuantum utama (n)
Nilai = 1, 2, 3, 4 .....dan seterusnya
Kegunaan = Menentukan tingkat energi atau kulit suatu elektron berada.
Jika:
n = 1
n = 2
n = 3
Dan seterusnya.
Bilangan kuantum azimuth (l)
Nilai = 0, 1, 2 .......sampai (n-1)
Jika:
n = 1
n = 2
n = 3
Dan seterusnya.
Kegunaan = Menyatakan di subkulit mana elektron berada
Jika:
l = 0
l = 1
l = 2
l = 3
Dan seterusnya.
Bilangan kuantum magnetik (m)
Nilai = - l, 0, +l
Kegunaan = Menyatakan di orbital mana elektron berada
Jika:
l = 0
l = 1
l = 2
Dan seterusnya.
Bilangan Kuantum Spin(s)
Nilai = +1/2 dan -1/2
Kegunaan = Menyatakan arah perputaran elektron
Jika arah panahnya keatas = +1/2
Jika arah panahnya kebawah = -1/2
Jawaban : B
Soal 2
Bilangan kuantum azimuth (l) yang masih dimungkinkan untuk l = 4 adalah . . . .
A. 1, 2, 3
B. 0, 1, 2, 3
C. 1, 2, 3, 4,
D. 0, 1, 2, 3, 4
E. Tidak bergantung pada harga n
Pembahasan :
Jika n = 4, maka :
Harga l = 0, .....(n-1) = 0, 1, 2, 3
Jawaban : B
Soal 3
Bilangan kuantum magnetik (m) = -3 dimiliki oleh elktron dari atom yang memiliki kulit elektron minimal sebanyak. . . .
A. 2
B. 3
C. 4
D. 5
D. 6
Pembahasan :
Jika memiliki m = -3, artinya nilai bilangan kuantum azimuth elektron dalam atom itu minimal adalah 3 karena nilai m itu bergantung pada harga l ( jika l = 3, maka harga m -nya = -3, -2, -1, 0, +1, +2, +3).
Untuk l = 3, maka minimal sebuah atom harus memiliki harga bilangan kuantum utama (n) adalah 4 karena nilai l itu dimulai dari 0, 1, ......sampai (n-1). Jadi jika n = 4, maka harga l = 0, 1, 2, 3.
Pada pembahasan soal no satu diatas sudah djelaskan bahwa bilangan kuantum utama menyatakan kulit atom. n = 4 artinya elektron berada pada tingkat energi ke empat atau kulit keempat (kulit N). Jadi agar suatu elektron memiliki nilai bilangan kuantum magnetik (m ) = - 3, maka atom itu harus memiliki setidaknya 4 buah kulit atom.
Jawaban : C
Menentukan Kemungkinan harga keempat bilangan kuantum yang mengisi suatu subkulit
Soal 4
Diantara harga keempat bilangan kuantum di bawah ini yang mungkin untuk pengisian elektron pada orbital 3p adalah . . . . .
A. n = 3, l = 2, m = -1, s = +1/2
B. n = 3, l = 1, m = -1, s = +1/2
C. n = 3, l = 2, m = +1, s = +1/2
D. n = 3, l = 2, m = 0, s = +1/2
E. n = 3, l = 2, m = +2, s = +1/2
Pembahasan :
Dari orbital 3p kita dapatkan :
Harga n = 3
Harga l = 1 (karena sub kulitnya adalah p)
Jika l = 1, maka harga m yang mungkin adalah -1, 0, +1
Harga s yang mungkin hanya dua yaitu +1/2 dan -1/2
Jadi kemungkina nilai keempat bilangan kuantum suatu elektron yang menempati subkulit/ orbital 3p adalah :
n = 3, l = 1, m = -1, 0, +1 dan s = +1/2 atau -1/2
Jawaban : B
Menentukan nilai bilangan kuantum suatu elektron dalam atom yang tidak diizinkan
Soal 5
Elektron yang memiliki bilangan kuantum yang tidak diizinkan adalah . . . . .
A. n = 3, l = 0, m = 0, s = - 1/2
B. n = 3, l = 1, m = 1, s = + 1/2
C. n = 3, l = 2, m = -1, s = + 1/2
D. n = 3, l = 1, m = 2, s = - 1/2
E. n = 3, l = 1, m = 2, s = + 1/2
Pembahasan :
Kita lihat optionnya, biasanya soal soal seperti ini punya ciri ciri yang sama yaitu harga n-nya sama untuk semua option, sehingga kita tidak perlu mengecek satu per-satu. Kalau berbeda?? ya...berarti harus di cek satu persatu ....
Pada option soal diatas nilai n = 3, maka:
Harga l = 0, 1, 2
Untuk l = 0
Untuk l = 1
Loading...
Untuk l = 2 m = -2, -1, 0 +1, +2
m = -2, -1, 0 +1, +2
Harga s yang mungkin adalah +1/2 dan -1/2
Kemungkinan harga bilangan kuantum yang diizinkan :
n = 3, l = 0, m= 0, s = +1/2 atau -1/2
n = 3, l =1, m = -1, 0, +1, s = +1/2 atau -1/2
n = 3, l = 2, m = -2, -1, 0, +1, +2, s = +1/2 atau -1/2
Option A, B, C dan E benar menurut kemungkinan diatas, Option D dengan n = 3, l = 1, m = 2, s = - 1/2 adalah salah karena jika harga l = 1, tidak memungkinkan untuk m-nya memiliki nilai 2.
Jawaban : D
Menentukan Harga Bilangan Kuantum Lainnya Jika Salah Satu Bilangan Kuantum Diketahui
Soal 6
Jika suatu elektron mempunyai bilangan kuantum utama , n = 2, kemungkinan bilangan kuantumlainnya adalah . . . .
A. l = 1, m = 0, s = +1/2
B. l = 1, m = 2, s = -1/2
C. l = 2, m = -2, s = +1/2
D. l = 2, m = 2, s = -1/2
E. l = 2, m = 0, s = +1/2
Pembahasan :
Jika n = 2, maka
Harga l = 0, 1
Untuk l = 0 m = 0
m = 0
Untuk l = 1 m = -1, 0, +1
m = -1, 0, +1
Harga s yang mungkin tentunya hanya dua yaitu +1/2 dan -1/2
Ada beberapa kemungkinan jawaban untuk bilangan kuantum lainnya
n = 2, l = 0, m = 0 , s = +1/2 atau -1/2
n = 2, l =1, m = -1, 0, +1, s = +1/2 atau -1/2
Jawaban : A
Menentukan nilai keempat bilangan kuantum elektron terakhir suatu atom
Soal 7
Suatu atom mempunyai konfigurasi elektron![[Ar]4s^{2}3d^{10}](https://latex.codecogs.com/gif.latex?[Ar]4s^{2}3d^{10}) . Elektron terakhir akan mempunyai bilangan kuantum . . . .
. Elektron terakhir akan mempunyai bilangan kuantum . . . .
A. n = 3, l = 2, m = 2
B. n = 3, l = 1, m = -1
C. n = 3, l = 3, m = 0
D. n = 3, l = 3, m = -3
E. n = 3, l = 3, m = -2
Pembahasan :
![[Ar]4s^{2}3d^{10}](https://latex.codecogs.com/gif.latex?[Ar]4s^{2}3d^{10})
Elektron terakhir tentu berada pada orbital 3d. Di bagian mana tepatnya?? kita harus membuat diagram orbitalnya terlebih dahulu.
![[Ar]4s^{2}3d^{10}](https://latex.codecogs.com/gif.latex?[Ar]4s^{2}3d^{10})
Dari orbital 3d kita dapatkan :
Harga n = 3
Harga l = 2 (karena sub kulitnya d)
Untuk l = 2, maka harga m yang mungkin adalah = -2, -1, 0, +1, +2. Setiap harga m mewakili satu kotak pada orbital 3d (lihat gambar). Elektron terakhir berada pada m = 2 dan arah perputaran elektron adalah ke bawah sehingga nilai s-nya adalah -1/2.
Jadi harga keempat bilangan kuantum untuk elektron terakhir atom tersebut adalah :
n = 3, l = 2, m = 2, s = - 1/2
Jawaban : A
Menentukan Nilai Keempat Bilangan Kuantum Elektron Terakhir Jika diketahui ionnya
Soal 8
Ion memiliki konfigurasi elektron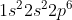 . Nilai keempat bilangan kuantum elektron terakhir dari atom X adalah . . . . .
. Nilai keempat bilangan kuantum elektron terakhir dari atom X adalah . . . . .
A. n = 3, l = 1, m = -1, s = +1/2
B. n = 3, l = 1, m = +1, s = +1/2
C. n = 3, l = 1, m = 0, s = -1/2
D. n = 2, l = 1, m = +1, s = +1/2
E. n = 2, l = 1, m = -1, s = -1/2
Pembahasan :
Ion memiliki konfigurasi elektron :
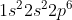
Jumlah elektron ion = 10
Ion terbentuk ketika atom X melepas 3 elektronnya, sehingga jumlah elektron atom X mula- mula adalah = 10 + 3 = 13 elektron
Konfigurasi elektron atom X dengan 13 elektron

Atau
![[Ne]3s^{2}3p^{1}](https://latex.codecogs.com/gif.latex?[Ne]3s^{2}3p^{1})
Diagram Orbital
Elektron terakhir berada pada orbital 3p, sehingga harga :
n = 3
l = 1 (sub kulit p)
m = -1 (lihat gambar, elektron berada pada kotak dengan m = -1)
s = +1/2 (karena arah panahnya keatas)
Jawaban : A
Menentukan Nomor Atom Suatu Unsur Berdasarkan Data Nilai Keempat Bilangan Kuantum Elektron Terakhir.
Soal 9
Elektron terakhir atom X memiliki 4 bilangan kuantum sebagai berikut.
n = 4, l = 1, m= 0, s = -1/2
Nomor atom unsur X tersebut adalah . . . .
A. 20
B. 25
C. 30
D. 35
E. 36
Pembahasan:
Jika n = 4, artinya elektron terakhir berada di tingkat energi ke empat.
Harga l = 1, artinya elektron berada pada subkulit p
Jadi, elektron terakhir berada pada orbital 4p.
Sekarang tugas selanjutnya adalah menentukan berapa jumlah elektron yang ada pada orbital 4p tersebut. Jika kita lihat nilai m = 0 artinya elektron terakhir berada pada kotak ditengah dari orbital p, dan s = -1/2 artinya arah panah elektron itu adalah ke bawah. Jika sudah diisi elektron dengan arah ke bawah artinya yang arah keatas sudah penuh terisi terlebih dahulu. Berarti jumlah elektron yang terdapat pada orbital 4p itu adalah 5 buah. Untuk lebih jelasnya silahkan perhatikan gambar berikut :
Elektron terakhir berada pada orbital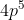
Langkah selanjutnya adalah menulis konfigurasi apa sebelum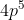 , yaitu :
, yaitu :
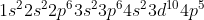
Jumlah elektron = Nomor atom = 35
Jawaban : D.
Harga s yang mungkin adalah +1/2 dan -1/2
Kemungkinan harga bilangan kuantum yang diizinkan :
n = 3, l = 0, m= 0, s = +1/2 atau -1/2
n = 3, l =1, m = -1, 0, +1, s = +1/2 atau -1/2
n = 3, l = 2, m = -2, -1, 0, +1, +2, s = +1/2 atau -1/2
Option A, B, C dan E benar menurut kemungkinan diatas, Option D dengan n = 3, l = 1, m = 2, s = - 1/2 adalah salah karena jika harga l = 1, tidak memungkinkan untuk m-nya memiliki nilai 2.
Jawaban : D
Menentukan Harga Bilangan Kuantum Lainnya Jika Salah Satu Bilangan Kuantum Diketahui
Soal 6
Jika suatu elektron mempunyai bilangan kuantum utama , n = 2, kemungkinan bilangan kuantumlainnya adalah . . . .
A. l = 1, m = 0, s = +1/2
B. l = 1, m = 2, s = -1/2
C. l = 2, m = -2, s = +1/2
D. l = 2, m = 2, s = -1/2
E. l = 2, m = 0, s = +1/2
Pembahasan :
Jika n = 2, maka
Harga l = 0, 1
Untuk l = 0
Untuk l = 1
Harga s yang mungkin tentunya hanya dua yaitu +1/2 dan -1/2
Ada beberapa kemungkinan jawaban untuk bilangan kuantum lainnya
n = 2, l = 0, m = 0 , s = +1/2 atau -1/2
n = 2, l =1, m = -1, 0, +1, s = +1/2 atau -1/2
Jawaban : A
Menentukan nilai keempat bilangan kuantum elektron terakhir suatu atom
Soal 7
Suatu atom mempunyai konfigurasi elektron
A. n = 3, l = 2, m = 2
B. n = 3, l = 1, m = -1
C. n = 3, l = 3, m = 0
D. n = 3, l = 3, m = -3
E. n = 3, l = 3, m = -2
Pembahasan :
Elektron terakhir tentu berada pada orbital 3d. Di bagian mana tepatnya?? kita harus membuat diagram orbitalnya terlebih dahulu.
Dari orbital 3d kita dapatkan :
Harga n = 3
Harga l = 2 (karena sub kulitnya d)
Untuk l = 2, maka harga m yang mungkin adalah = -2, -1, 0, +1, +2. Setiap harga m mewakili satu kotak pada orbital 3d (lihat gambar). Elektron terakhir berada pada m = 2 dan arah perputaran elektron adalah ke bawah sehingga nilai s-nya adalah -1/2.
Jadi harga keempat bilangan kuantum untuk elektron terakhir atom tersebut adalah :
n = 3, l = 2, m = 2, s = - 1/2
Jawaban : A
Menentukan Nilai Keempat Bilangan Kuantum Elektron Terakhir Jika diketahui ionnya
Soal 8
Ion memiliki konfigurasi elektron
A. n = 3, l = 1, m = -1, s = +1/2
B. n = 3, l = 1, m = +1, s = +1/2
C. n = 3, l = 1, m = 0, s = -1/2
D. n = 2, l = 1, m = +1, s = +1/2
E. n = 2, l = 1, m = -1, s = -1/2
Pembahasan :
Ion memiliki konfigurasi elektron :
Jumlah elektron ion = 10
Ion terbentuk ketika atom X melepas 3 elektronnya, sehingga jumlah elektron atom X mula- mula adalah = 10 + 3 = 13 elektron
Konfigurasi elektron atom X dengan 13 elektron
Atau
Diagram Orbital
Elektron terakhir berada pada orbital 3p, sehingga harga :
n = 3
l = 1 (sub kulit p)
m = -1 (lihat gambar, elektron berada pada kotak dengan m = -1)
s = +1/2 (karena arah panahnya keatas)
Jawaban : A
Menentukan Nomor Atom Suatu Unsur Berdasarkan Data Nilai Keempat Bilangan Kuantum Elektron Terakhir.
Soal 9
Elektron terakhir atom X memiliki 4 bilangan kuantum sebagai berikut.
n = 4, l = 1, m= 0, s = -1/2
Nomor atom unsur X tersebut adalah . . . .
A. 20
B. 25
C. 30
D. 35
E. 36
Pembahasan:
Jika n = 4, artinya elektron terakhir berada di tingkat energi ke empat.
Harga l = 1, artinya elektron berada pada subkulit p
Jadi, elektron terakhir berada pada orbital 4p.
Sekarang tugas selanjutnya adalah menentukan berapa jumlah elektron yang ada pada orbital 4p tersebut. Jika kita lihat nilai m = 0 artinya elektron terakhir berada pada kotak ditengah dari orbital p, dan s = -1/2 artinya arah panah elektron itu adalah ke bawah. Jika sudah diisi elektron dengan arah ke bawah artinya yang arah keatas sudah penuh terisi terlebih dahulu. Berarti jumlah elektron yang terdapat pada orbital 4p itu adalah 5 buah. Untuk lebih jelasnya silahkan perhatikan gambar berikut :
Elektron terakhir berada pada orbital
Langkah selanjutnya adalah menulis konfigurasi apa sebelum
Jumlah elektron = Nomor atom = 35
Jawaban : D.
Nah itulah tadi telah diuraikan mengenai Soal dan Pembahasan tentang Bilangan Kuantum Kelas 10 SMA. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
Loading...







