Selamat Datang kembali di blog freemathlearn. Blog yang membahas seputar matematika dan ilmu sains lainnya. Baiklah untuk kali ini akan kita bahas mengenai
Pengertian Sistem, Lingkungan, Energi Dalam, Entalpi. Silakan disimak ya guys!
>
Nah itulah tadi telah diuraikan mengenai Pengertian Sistem, Lingkungan, Energi Dalam, Entalpi. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
>
Setiap materi mempunyai energi. Ketika materi materi ini bereaksi dalam suatu reaksi kimia, ada dua kemungkinan peristiwa yang terjadi terhadap energi yang dikandung oleh senyawa senyawa tersebut. Kemungkinan pertama adalah ketika senyawa senyawa bereaksi, maka akan dilepaskan sejumlah energi atau kemungkinan kedua adalah agar senyawa senyawa tersebut dapat bereaksi maka akan dilakukan penyerapan energi. Artinya dalam suatu rekasi kimia selalu ada energi yang menyertainya baik pelepasan atau penyerapan energi. Ilmu kimia yang mempelajari tentang energi yang menyertai suatu reaksi kimia disebut dengan Termokimia (Termo = Panas/ energi / kalor).
Dalam mempelajari termokimia kita harus mengenal beberapa istilah yang sering dan akan kita gunakan untuk memahami konsep ini :
Sistem, Lingkungan dan Alam Semesta
Sistem adalah bagian tertentu dari alam yang menjadi pusat perhatian.
Lingkungan adalah segala sesuatu yang berada diluar sistem.
Contoh :
Ketika kita akan mereaksikan dua zat, misalkan saja zat A dan zat B dalam tabung reaksi di laboratorium, yang ingin kita perhatikan adalah gejalanya apa yang akan terjadi ketika dua zat A dan B ini kita reaksikan. Yang menjadi pusat perhatian kita adalah zat A dan zat B sehingga kedua zat ini bertindak sebagai sistem. Sementara tabung reaksi, udara disekitar reaksi dan laboratorium tempat melangsungkan reaksi adalah lingkungannya.
Note :
Dalam kimia bisanya yang menjadi sistem selalu zat yang akan bereaksi.
Umumnya sistem lebih kecil dibandingkan lingkungannya. Di alam tentu ada banyak sistem, ada yang berukuran besar (tata surya) dan ada pula yang berukuran kecil (reaksi kimia dalam tabung reaksi). Suatu sistem kecil mungkin terdapat dalam sistem yang lebih besar, artinya sistem besar ini adalah lingkungan dari sistem yang kecil. Jika kita jumlahkan antara sistem yang ada di alam dengan lingkunannnya maka itulah yang disebut dengan alam semesta.
Jadi,
Alam semesta adalah jumlah dari sistem dan lingkungan.
Sistem tentu mengandung materi dan energi, begitu juga lingkungannya. Materi dan energi ini dapat berpindah dari sistem ke lingkungan atau sebaliknya. Antara sistem dan lingkunan memiliki batas, yang disebut dengan dinding. Dinding ini ada yang bersifat diatermal (tembus energi) atau adiatermal(tidak tembus energi).
Berdasarkan batas/ dinding antara sistem dan lingkungan ini, maka ada tiga jenis sistem, yaitu :
Sistem terbuka
Sistem terbuka adalah sistem yang memungkinkan terjadinya perpinsahan energi dan materi ke lingkungan.
Contoh :
Air panas dalam gelas yang terbuka lama kelamaan akan menjadi dingin. artinya ada perpindahan panas dari air (sistem) ke udara sekitar (lingkungan) yang mebuat suhu air menurun. Jika kita biarkan sedikit lebih lama, maka air yang ada dalam gelas tentu akan menguap ke udara sehingga jumlahnya berkurang. Pada saat seperti ini terjadi perpindahan materi. Sistem seperti air panas dalam gelas terbuka ini adalah contoh sistem terbuka.
Sistem tertutup
sistem tertutup adalah sistem yang hanya memungkinkan terjadinya perpindahan energi ke lingkungan.
Contoh :
Jika air panas tadi kita letakkan dalam gelas tertutup, maka lama kelamaan air juga akan menjadi dingin sebab terjadi perpindahan energi dari sistem ke lingkungan Tetapi jumlah air akan tetap sama walaupun kita biarkan lebih lama karena ada tutup pada gelasnya.
Sistem terisolasi
Sistem terisolasi adalah sistem yang tidak memungkinkan terjadinya perpindahan kalor maupun materi dari sistem ke lingkungan.
Contoh:
Air dalam termos yang tetap panas walaupun sudah didiamkan lama.
Kerja dan Kalor
Sistem yang tidak seimbang dengan lingkungannya cenderung untuk berubah sampai terbentuk kesetimbangan. Perubahan ini dapat berupa kalor atau kerja.
Kerja (w)
Jika sebuah pompa yang berisi gas dengan piston memiliki tekanan udara di dalam pompa lebih besar dibandingkan dengan tekanan udara di luar, maka gas yang berada di dalam pompa akan mendorong piston sedemikian rupa sampai tekanan udara didalam pompa sama dengan tekanan udara luar. Pergeseran piston ini akan mengubah volume sistem menjadi lebh besar dimana peristiwa ini disebut dengan ekspansi. Untuk menggeser piston ini tentu diperlukan energi dari sistem yang disebut dengan kerja volume (kerja yang menghasilkan perubahan volume). Nilai kerja ini bergantung pada penambahan volume sistem dan tekanan udara luar.
Kalor (q)
Kalor adalah energi mekanik akibat gerakan partikel materi, dan dapat berpundah dari suatu tempat ke tempat lain. Jika suatu sistem mepunyai dinding diatermal dan suhunya lebih tinggi dari lingkungan maka kalor dapat keluar dari sistem, Sebaliknya jika suhu lingkungannnya loebih tinggi dibandingkan sistem maka kalor akan masuk ke dalam sistem.
Perpindahan kalor ini dapat terjadi secara konduksi, koveksi mapupun radiasi.
Energi Dalam (U)
Setiap sistem mempunyai energi karena partikel partikel materi (padat, cai dan gas) selalu bergerak acak dan beragam.
Gerakan ini dapat berupa :
- Tranlasi (gerakan berpindah tempat), Rotasi (gerakan berputa), dan Vibrasi (gerakan bergetar)
- Perpindahan tingkat energi elektron dalam atom atau molekul.
Jumlah total energi yang terkadung dalam suatu sistem ini disebut dengan energi dalam (U).
Gerakan setiap partikel dipengaruhi oleh berbagai macam faktor dan antara satu partikel yang satu dengan partikel yang lain gerakannya tidak sama, sehingga energi yang dikandung dalam setiap materi juga tidak sama. Akibatnya energi dalam (U) suatu sistem tidak dapat diketahu nilai mutlaknya.
Hukum Pertama Termodinamika
Bila suatu sistem mengalami peristiwa, maka energi dalam sistem juga akan berubah (misalkan dari U1=keadaan awal, ke U2= keadaan akhir). Perubahan energi dalam dapat kita ketahui dari perubahan suhu sistem. JIka suhunya naik, maka gerakan partikel dalam sistem akan cepat sehingga enegri dalam sistem bertambah, sebaliknya jika suhu turun maka energi dalam sistem juga akan turun. Jadi perubahan energi dalam sistem dapat kita ketahui dari perubahan suhu sistem.
Bagaimana jika sistem itu terdapat dalam sebuah pompa yang memiiki piston?? Jika pompa kita panaskan maka gerakan parikel materi dalam pompa akan semakin cepat sehingga mendorong piston dan energi dalam materi juga ikut bertambah. Akibatnya akan terjadi perubahan volume sistem. Dengan kata lain ketika kalor kita berikan ke sistem, maka kalor itu sebagian akan disimpan dalam bentuk energi dalam (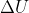 ) dan sebagian lain digunakan oleh sistem untuk melakukan kerja volume yaitu mendorong piston. Secara matematika dapat kita tulis :
) dan sebagian lain digunakan oleh sistem untuk melakukan kerja volume yaitu mendorong piston. Secara matematika dapat kita tulis :
Rumusan diatas merupakan rumusan pertama hukum termodinamika
"Energi tidak adapt diciptakan atau dimusnahkan, tetapi dapat diubah dari suatu bentuk ke bentuk lainnya"
atau
"Energi alam semesta adalah konstan"
Sehingga hukum pertama termodinamika disebut juga dengan hukum kekekalan energi.
Agar tidak keliru menggunakan rumus diatas, maka ditetapkanlah suatu perjanjian, yaitu :
- Kalor (q) yang masuk ke sistem bertanda positif (+), sedangkan kalor yang keluar bertanda negatif (- )
- Kerja (w) yang dilakuka sistem (ekspansi) bertanda negatif (-) sedangkan kerja yang dilakukan lingkungan (kompresi) bertanda positif (+)
Kerja dihitung dengan menggunakan rumus :
w = - P (V2 - V1)
Dengan :
w = Kerja (L atm)
V1 = Volume awal
V2 = Volume akhir
P = Tekanan
Contoh soal :
Suatu sistem menyerap kalor 35 J dan kerja 20 J. Hitunglah :
a. q, w dan sistem
b. q, w dan lingkungan
Pembahasan :
Sistem menyerap kalor artinya kalor masuk kedalam sistem sehinnga bertanda positif (+).
Jika sistem menyerap kalor maka lingkungannya akan kehilangan kalor (kalor keluar dari lingkungan) sebanyak yang masuk ke dalam sistem sehingga bertanda negatif (-)
Sistem
q = + 35 J
w = - 20 J (karena sistem yang melakukan kerja. Hal ini dapat diketahui dari sistem yang menyerap kalor mengakibatkan tekanan dalam sistem akan lebih besar dibandingkan tekanan udara luar, sehingga sistem akan melakukan kerja volume)
Lingkungan
q = - 35 J
w = + 20 J
Entalpi (H)
Jika sebuah pompa yang berisi gas mula - mula stabil (Pin = Pex) dan kemudian diberi kalor sebesar q, maka gerakan partikel dalam sistem akan semakin cepat sehinnga secara perlahan akan terjadi ekspansi (kerja) sampai tekanan udara di dalam pompa sama dengan tekanan udara luar. Sesuai dengan hukum pertama termodinamika :
Loading...
Dari persamaan diatas dapat dilihat bahwa nilai q bergantung pada U, dan PV. U dan PV ini adalah bentuk energi pada sistem yang jika kita jumlahkan hasilnya disebut dengan entalpi (H). Jadi entalpi adalah jumlah total energi (energi dalam (U) dan PV (kerja)) yang terkandung dalam sistem.
Secara matematis dapat ditulis :
Jika sistem mengalami perubahan entalpi, maka :
Kebanyakan reaksi kimia dilakukan dalam keadaan dimana tekanan udara luar sama dengan tekanan udara di dalam sistem (dilakukan pada ruang terbuka) sehingga 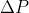 = 0. Akibatnya kalor yang diserap atau dilepaskan oleh sistem akan sama dengan perubahan entalpinya.
= 0. Akibatnya kalor yang diserap atau dilepaskan oleh sistem akan sama dengan perubahan entalpinya.
Secara matematika :
Inilah yang disebut dengan perubahan entalpi, yaitu kalor yang diserap atau dilepaskan oleh sistem pada tekanan tetap.
Dalam suatu reaksi kimia, misalkan :
Sehingga perubahan entalpi dapat kita tulis :
Hanya ada dua kemungkinan nilai , yaitu bertanda positif (+) dan bertanda negatif (-). Berdasarkan hal ini ada dua jenis reaksi termokimia
Reaksi Termokimia
Reaksi eksoterm
Jika reaksi melepaskan kalor (kalor dilepaskan dari sistem ke lingkungannya) maka entalpi produk akan lebih kecil dibandingkan entalpi reaktan karena energi pada sistem berkurang, Akibatnya :
Reaksi yang melepaskan kalor dari sistem ke lingkungan sehingga nilai  bertanda negatif ( - ) adalah reaksi eksoterm.
bertanda negatif ( - ) adalah reaksi eksoterm.
Berikut beberapa ciri ciri reaksi eksoterm :
1. Umumnya terjadi peningkatan suhu.
3. Energi mengalir dari sistem ke lingkungan
Diagram tingkat energinya :
Beberapa contoh reaksi eksoterm dalam kehidupan sehari hari :
Reaksi pembakaran (reaksi oksidasi)
Reaksi netralisasi asam basa
Reaksi Korosi
Reaksi Polimerisasi
Reaksi Fermentasi
Reaksi Respirasi
Reaksi pada dekomposisi tumbuhan menjadi kompos
Reaksi logam aktif dengan air (IA, IIA, IIIA, Al dan Mn)
Reaksi Endoterm
Jika reaksi menyerap kalor ( kalor masuk dari lingkungan ke sistem ) maka entalpi produk akan lebih besar dibandingkan dengan entalpi reaktan akibat energi pada sistem bertambah. Akibatnya :
Reaksi yang menyerap kalor dari lingkungan ke sistem sehingga nilai  bertanda (+) adalah reaksi endoterm
bertanda (+) adalah reaksi endoterm
Berikut beberapa ciri ciri reaksi endoterm
1. Umumnya terjadi penurunan suhu
3. Energi mengalir dari lingkunga ke sistem
Diagram tingkat energinya :
Beberapa contoh reaksi endoterm
Reaksi fotosintesis
Perubahan wujud ke fase yang lebih ringan
Reaksi Cracking molekul alkana
Pelarutan urea dalam air.
.
Nah itulah tadi telah diuraikan mengenai Pengertian Sistem, Lingkungan, Energi Dalam, Entalpi. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
Loading...








