Selamat Datang kembali di blog freemathlearn. Blog yang membahas seputar matematika dan ilmu sains lainnya. Baiklah untuk kali ini akan kita bahas mengenai
Penyelesaian Soal Menghitung pH Larutan Asam dan Basa Kuat. Silakan disimak ya guys!
>
Nah itulah tadi telah diuraikan mengenai Penyelesaian Soal Menghitung pH Larutan Asam dan Basa Kuat. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
>
Soal 1
Larutan Vitamin C dan air jeruk sama sama memilki pH sebesar . . . .
A. 0
B. < 7
C. 7
D. > 7
E. 14
Pembahasan
Kita mulai dari soal mudah terlebih dahulu. Kalian pasti sudah sering memakan Vitamin C saat sarawan atau makan buah jeruk bukan. Nah rasanya hampir mirip yaitu masam. Dari rasa ini kita bisa ketahui bahwa kedua senyawa tersebut adalah senyawa asam. Senyawa asam memiliki pH < 7, sampai 1.
pH basa adalah > 7 sampai 14.
pH larutan netral = 7
Jadi kisaran pH adalah dari 1 - 14, tidak ada pH yang bernilai nol. Semakin mendekati 1, maka asamnya semakin kuat, sedangkan semakin mendekati 14, maka basanyalah yang semakin kuat.
Jawaban : B
Soal 2
Senyawa asam berikut yang memiliki valensi dua adalah . . . .
A. asam fosfat
B. asam nitrat
C. asam sianida
D. asam iodida
E. asam sulfat
Pembahasan :
Untuk menentukan berapa valensi suatu asam tentau kalian harus mengetahui rumus molekul asam terlebih dahulu. Valensi asam adalah jumlah H+ yang dapat dilepas oleh molekul asam, jika hanya melepas satu H+ maka disebut asam valensi satu, jika melepas dua ion H+ maka disebut asam bervalnsi dua dan seterusnya.
Nah, kelas 10 kalian tentu sudah belajar cara membuat rumus molekul dari namanya termasuk nama asam, Umumnya asam adalah gabungan beberapa atom H dengan anion poliatomik.
Asam fosfat =
Ionisasi = , Valensi asam = 3
, Valensi asam = 3
Asam nitrat = HNO3
Ionisasi = , Valensi asam = 1
, Valensi asam = 1
Asam sianida = HCN
Ionisasi = Valensi asam = 1
Valensi asam = 1
Asam iodida = HI
Ionisasi = Valensi asam = 1
Valensi asam = 1
Asam sulfat = H2SO4
Ionisasi = Valensi asam = 2
Valensi asam = 2
Dari ionisasi asam diatas dapat kita lihat denan jelas bahwa asam yang bervalensi dua yaitu asam yang melepaskan 2 buah ion H+ adalah asam sulfat dengan rumus molekul H2SO4.
Jawaban E
Soal 3
Penambahan ion OH- kedalam air dapat mengakibatkan . . . . .
A. pH air menurun
B. air tetap bersifat netral
C. air berubah sifat menjadi basa
D. air berubah sifat menjadi asam
E. konsentrasi ion H+ dalam air bertambah
Pembahasan :
Jawabannya pasti air akan mejadi basa dan konsentrasi ion OH- dlam larutan bertambah.
Air memiliki pH netral = 7
Artinya pada saat ini jumlah ion H+ sama dengan jumlah ion OH-. Ketika ditambahkan ion OH- kedalam air, maka jumlah ion OH- akan berlebih sementara ion H+ tetap. pH air ditentukan oleh jumlah ion OH- yang belebih ini, maka akan didapatkan pH air > 7 sehingga larutan bersifat basa.
Jumlah H+ < jumlah OH-, maka larutan bersifat basa.
Jawaban : C
Soal 4
Tersedia beberapa larutan berikut.
1. NH4OH
2. NaOH
3. Air sabun
4. Cuka
5. Air deterjen
Diantara larutan berikut yang mempunyai [H+] lebih besar dibanndingkan [OH-] dalam air ditunjukkan oleh nomor . . . .
A. 1
B. 2
C. 3
D. 4
E. 5
Pembahasan :
Jika [H+] > [OH-] = larutan bersifat asam
Maka carilah senyawa asam pada beberapa larutan diatas. NH4OH, NaOH, air sabun dan deterjen adalah senyawa basa yang pasti [OH-] nya lebih besar dibandingkan [H+]. senyawa yang [H+] lebih besar dibandingkan [OH-] adalah asam cuka dengan rumus molekul CH3COOH.
Jawaban : D
Soal 5
Diketahui data pH dari 0,1 M larutan asam berikut.
No 1 2 3 4 5
Asam HA HB HC HD HE
pH 6,8 2,2 5,4 3,5 2,5
Berdasarkan data diatas, maka urutan larutan asam dari yang paling kuat adalah . . . .
A. 1, 3, 4, 2, 5
B. 1, 4, 2, 3, 5
C. 2, 5, 4, 3, 1
D. 5, 2, 4, 3, 1
E. 5, 4, 3, 2, 1
Pembahasan :
Seperti yang sudah saya jelaskan sebelumnya bahwa semakin kecil pHnya tentu asamnya akan semakin kuat. Alasannya adalah jumlah H+ nya pada pH kecil akan lebih banyak dibandingkan pH besar.
Contoh :
pH = 1 ===> [H+] = 1 x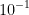
Larutan Vitamin C dan air jeruk sama sama memilki pH sebesar . . . .
A. 0
B. < 7
C. 7
D. > 7
E. 14
Pembahasan
Kita mulai dari soal mudah terlebih dahulu. Kalian pasti sudah sering memakan Vitamin C saat sarawan atau makan buah jeruk bukan. Nah rasanya hampir mirip yaitu masam. Dari rasa ini kita bisa ketahui bahwa kedua senyawa tersebut adalah senyawa asam. Senyawa asam memiliki pH < 7, sampai 1.
pH basa adalah > 7 sampai 14.
pH larutan netral = 7
Jadi kisaran pH adalah dari 1 - 14, tidak ada pH yang bernilai nol. Semakin mendekati 1, maka asamnya semakin kuat, sedangkan semakin mendekati 14, maka basanyalah yang semakin kuat.
Jawaban : B
Soal 2
Senyawa asam berikut yang memiliki valensi dua adalah . . . .
A. asam fosfat
B. asam nitrat
C. asam sianida
D. asam iodida
E. asam sulfat
Pembahasan :
Untuk menentukan berapa valensi suatu asam tentau kalian harus mengetahui rumus molekul asam terlebih dahulu. Valensi asam adalah jumlah H+ yang dapat dilepas oleh molekul asam, jika hanya melepas satu H+ maka disebut asam valensi satu, jika melepas dua ion H+ maka disebut asam bervalnsi dua dan seterusnya.
Nah, kelas 10 kalian tentu sudah belajar cara membuat rumus molekul dari namanya termasuk nama asam, Umumnya asam adalah gabungan beberapa atom H dengan anion poliatomik.
Asam fosfat =
Ionisasi =
Asam nitrat = HNO3
Ionisasi =
Asam sianida = HCN
Ionisasi =
Asam iodida = HI
Ionisasi =
Asam sulfat = H2SO4
Ionisasi =
Dari ionisasi asam diatas dapat kita lihat denan jelas bahwa asam yang bervalensi dua yaitu asam yang melepaskan 2 buah ion H+ adalah asam sulfat dengan rumus molekul H2SO4.
Jawaban E
Soal 3
Penambahan ion OH- kedalam air dapat mengakibatkan . . . . .
A. pH air menurun
B. air tetap bersifat netral
C. air berubah sifat menjadi basa
D. air berubah sifat menjadi asam
E. konsentrasi ion H+ dalam air bertambah
Pembahasan :
Jawabannya pasti air akan mejadi basa dan konsentrasi ion OH- dlam larutan bertambah.
Air memiliki pH netral = 7
Artinya pada saat ini jumlah ion H+ sama dengan jumlah ion OH-. Ketika ditambahkan ion OH- kedalam air, maka jumlah ion OH- akan berlebih sementara ion H+ tetap. pH air ditentukan oleh jumlah ion OH- yang belebih ini, maka akan didapatkan pH air > 7 sehingga larutan bersifat basa.
Jumlah H+ < jumlah OH-, maka larutan bersifat basa.
Jawaban : C
Soal 4
Tersedia beberapa larutan berikut.
1. NH4OH
2. NaOH
3. Air sabun
4. Cuka
5. Air deterjen
Diantara larutan berikut yang mempunyai [H+] lebih besar dibanndingkan [OH-] dalam air ditunjukkan oleh nomor . . . .
A. 1
B. 2
C. 3
D. 4
E. 5
Pembahasan :
Jika [H+] > [OH-] = larutan bersifat asam
Maka carilah senyawa asam pada beberapa larutan diatas. NH4OH, NaOH, air sabun dan deterjen adalah senyawa basa yang pasti [OH-] nya lebih besar dibandingkan [H+]. senyawa yang [H+] lebih besar dibandingkan [OH-] adalah asam cuka dengan rumus molekul CH3COOH.
Jawaban : D
Soal 5
Diketahui data pH dari 0,1 M larutan asam berikut.
No 1 2 3 4 5
Asam HA HB HC HD HE
pH 6,8 2,2 5,4 3,5 2,5
Berdasarkan data diatas, maka urutan larutan asam dari yang paling kuat adalah . . . .
A. 1, 3, 4, 2, 5
B. 1, 4, 2, 3, 5
C. 2, 5, 4, 3, 1
D. 5, 2, 4, 3, 1
E. 5, 4, 3, 2, 1
Pembahasan :
Seperti yang sudah saya jelaskan sebelumnya bahwa semakin kecil pHnya tentu asamnya akan semakin kuat. Alasannya adalah jumlah H+ nya pada pH kecil akan lebih banyak dibandingkan pH besar.
Contoh :
pH = 1 ===> [H+] = 1 x
Loading...
pH = 6 ===> [H+] = 1 x 
Nah dapat dilihat dari penjelasan diatas bahwa [H+] pada pH 1 jauh lebih besar dibandingkan pada pH 6. Jadi kesimpulannya adalah, semakin kecil (mendekati 1) pH suatu sama maka asamnya akan semakin kuat.
Jadi urutan kekuatan asam senyawa pada soal diatas adalah 2 - 5 - 4 3 - 1
Jawaban : C
Soal 6
Sebanyak 1,96 gram H2SO4 (Ar H = 1, S = 32 dan O = 16) dilarutkan kedalam 200 mL air, maka pH larutan yang terbentuk sebesar . . . .
A. 1 - log 2
B. 2 - log 1
C. 3 - log 2
D. 4 - log 1
E. 5 - log 2
Pembahasan :
H2SO4 adalah asam kuat. Pertama kita cari dulu berapa konsentrasi H+ dari 1,96 gram H2SO4 dalam 200 mL air.
mol H2SO4 = gr/ Mr = 1,96 / 98 = 0,02 mol
M H2SO4 = n/V = 0,02 mol /0,2 L = 0,1 M
[H+] asam kuat = Valensi asam x M
= 2 x 0,1 M
= 0,2 M
=
pH = - log [H+] = - log = 1 - log 2
= 1 - log 2
Jawaban : A
Soal 7
Sutu larutan basa kuat memiliki pH = 13 + log 2, konsentrasi ion OH- dalam larutan tersebut adalah . . . .
A.1 x
B. 2
C. 2
D. 13
E. 13
Pembahasan :
pH + pOH = pKw
(13 + log 2) + pOH = 14
pOH = 14 - ( 13 + log 2)
= 1 - log 2
[OH-] = 2
Jawaban : B
Soal 8
Sebanyak 300 mL larutan 0,04 M HCl dicampur dengan 200 mL larutan 0,05 M H2SO4 0,05 M. Besarnya [H+] dalam larutan tersebut adalah . . . .M
A. 0,032
B. 0,064
C. 0,32
D. 0,64
E. 1,60
Pembahasan :
Untuk mencari mol H+ atau mol OH- setelah dua asam atau basa dicampur adalah sebagai berikut :
![[H+]_{campuran} = \frac{(M_{1}V_{1}\: x\: valensi asam 1)+(M_{2}V_{2}\: x\: valensi asam)}{V1 + V2}](https://latex.codecogs.com/gif.latex?[H+]_{campuran}&space;=&space;\frac{(M_{1}V_{1}\:&space;x\:&space;valensi&space;asam&space;1)+(M_{2}V_{2}\:&space;x\:&space;valensi&space;asam)}{V1&space;+&space;V2})
![[H+]_{campuran} = \frac{(0,04 M \: x \: 300\: mL\: x\:1)+(200 mL\: x\: 0,05 M\: x\:2)}{300 mL + 200 mL}](https://latex.codecogs.com/gif.latex?[H+]_{campuran}&space;=&space;\frac{(0,04&space;M&space;\:&space;x&space;\:&space;300\:&space;mL\:&space;x\:1)+(200&space;mL\:&space;x\:&space;0,05&space;M\:&space;x\:2)}{300&space;mL&space;+&space;200&space;mL})
![[H+]_{campuran} = \frac{(12\: mmol + 20\: mmol)}{500 mL}](https://latex.codecogs.com/gif.latex?[H+]_{campuran}&space;=&space;\frac{(12\:&space;mmol&space;+&space;20\:&space;mmol)}{500&space;mL})
![[H+]_{campuran} =\: 0,064 \: M](https://latex.codecogs.com/gif.latex?[H+]_{campuran}&space;=\:&space;0,064&space;\:&space;M)
Jawaban : D
Soal 9
Untuk memperoleh suatu larutan yang mengandung ion OH- sebanyak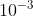 mol/L, Kedalam 250 mL air murni dilarutkan NaOH padat (volume diabaikan) sebanyak . . . .mg. (Mr NaOH = 40)
mol/L, Kedalam 250 mL air murni dilarutkan NaOH padat (volume diabaikan) sebanyak . . . .mg. (Mr NaOH = 40)
A. 1
B. 2,5
C. 5
D. 10
E. 40
Pembahasan :
Dalam soal disebutkan ion OH- sebanyak =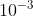 mol/L =
mol/L = 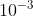 M
M
Volume = 250 mL
mol NaOH = M x V =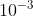 M x 250 mL = 0,25 mmol
M x 250 mL = 0,25 mmol
Massa NaOH = n x Mr = 0,25 mmol x 40 =10 mg
Jawaban : D.
Nah dapat dilihat dari penjelasan diatas bahwa [H+] pada pH 1 jauh lebih besar dibandingkan pada pH 6. Jadi kesimpulannya adalah, semakin kecil (mendekati 1) pH suatu sama maka asamnya akan semakin kuat.
Jadi urutan kekuatan asam senyawa pada soal diatas adalah 2 - 5 - 4 3 - 1
Jawaban : C
Soal 6
Sebanyak 1,96 gram H2SO4 (Ar H = 1, S = 32 dan O = 16) dilarutkan kedalam 200 mL air, maka pH larutan yang terbentuk sebesar . . . .
A. 1 - log 2
B. 2 - log 1
C. 3 - log 2
D. 4 - log 1
E. 5 - log 2
Pembahasan :
H2SO4 adalah asam kuat. Pertama kita cari dulu berapa konsentrasi H+ dari 1,96 gram H2SO4 dalam 200 mL air.
mol H2SO4 = gr/ Mr = 1,96 / 98 = 0,02 mol
M H2SO4 = n/V = 0,02 mol /0,2 L = 0,1 M
[H+] asam kuat = Valensi asam x M
= 2 x 0,1 M
= 0,2 M
=
pH = - log [H+] = - log
Jawaban : A
Soal 7
Sutu larutan basa kuat memiliki pH = 13 + log 2, konsentrasi ion OH- dalam larutan tersebut adalah . . . .
A.1 x
B. 2
C. 2
D. 13
E. 13
Pembahasan :
pH + pOH = pKw
(13 + log 2) + pOH = 14
pOH = 14 - ( 13 + log 2)
= 1 - log 2
[OH-] = 2
Jawaban : B
Soal 8
Sebanyak 300 mL larutan 0,04 M HCl dicampur dengan 200 mL larutan 0,05 M H2SO4 0,05 M. Besarnya [H+] dalam larutan tersebut adalah . . . .M
A. 0,032
B. 0,064
C. 0,32
D. 0,64
E. 1,60
Pembahasan :
Untuk mencari mol H+ atau mol OH- setelah dua asam atau basa dicampur adalah sebagai berikut :
Jawaban : D
Soal 9
Untuk memperoleh suatu larutan yang mengandung ion OH- sebanyak
A. 1
B. 2,5
C. 5
D. 10
E. 40
Pembahasan :
Dalam soal disebutkan ion OH- sebanyak =
Volume = 250 mL
mol NaOH = M x V =
Massa NaOH = n x Mr = 0,25 mmol x 40 =10 mg
Jawaban : D.
Nah itulah tadi telah diuraikan mengenai Penyelesaian Soal Menghitung pH Larutan Asam dan Basa Kuat. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
Loading...





