Selamat Datang kembali di blog freemathlearn. Blog yang membahas seputar matematika dan ilmu sains lainnya. Baiklah untuk kali ini akan kita bahas mengenai
Soal Pilihan Ganda tentang Reaksi Redoks. Silakan disimak ya guys!
>
Bilangan oksidasi Cl dari – 1 sampai dengan +7. Ion atau molekul dibawah ini yang tidak dapat mengalami rekasi disproporsionasi adalah . . . . .
A. Cl2 dan HClO4
B. HCl dan HClO2
C. ClO2 dan HClO3
D. Cl2 dan KClO3
E. Cl- dan NaClO4
Soal 2
Diketahui reaksi redoks berikut.
aCr2O72-(aq) + bH+(aq) + cCl-(aq) dCr3+ + eH2O(l) + fCl2(g)
dCr3+ + eH2O(l) + fCl2(g)
Harga koefisien reaksi untuk a, b dan c berturut turut adalah . . . .
A. 1, 2 dan 4
B. 1, 2 dan 2
C. 1, 14 dan 2
D. 1, 14 dan 6
E. 2, 7 dan 6
Soal 3
Reaksi reaksi dibawah ini termasuk rekasi redoks kecuali . . . .
A. Zn + H2SO4 ZnSO4 + H2
ZnSO4 + H2
B. SO3 + H2O H2SO4
H2SO4
C. Cl2 + 2NaOH NaCl + NaClO + H2O
NaCl + NaClO + H2O
D. Cu + CuCl2 2CuCl
2CuCl
E. Cl2 + 2KBr 2KCl + Br2
2KCl + Br2
Soal 4
Diketahui rekasi redoks :
CuO + H2 Cu + H2O
Cu + H2O
Zat yang bertindak sebagai oksidator pada reaksi tersebut adalah . . . .
A. Cu
B. H2
C. Cu2+
D. H+
E. O2-
Soal 5
Pernyataan yang benar pada reaksi
Cr2O3 + KClO3 + KOH K2CrO4 + KCl + 2H2O
K2CrO4 + KCl + 2H2O
Adalah . . . . .
A. KOH sebagai reduktor
B. Cr2O3 mengalami reduksi
C. KCl sebagai hasil reduksi
D. H2O sebagai hasil oksidasi
E. Bilangan oksidasi Cr dalam K2CrO4 adalah +7
Soal 6
Dalam ion H2P2O7-2 bilangan oksidasi P adalah . . . .
a. 2
b. 3
c. 4
d. 5
e. 6
Soal 7
Perubahan bilangan oksidasi unsur nitrogen pada reaksi :
CuS + NO3- Cu2+ + S + NO
Cu2+ + S + NO
Adalah . . . .
A. Berkurang 3
B. Bertambah 3
C. Berkurang 2
D. Betambah 2
E. Bertambah 5
Soal 8
Gas klorin (Cl2) yang ditambahkan kedalam pengolahan air minum dan kolam renang bertujuan untuk membunuh bakteri. Reaksi pemebntukan gas klorin sebagai berikut :
2NaCl + 2H2O H2 + Cl2 + 2NaOH
Zat yang berperan sebagai reduktor adalah . . . .
A. Cl2
B. H2
C. H2O
D. NaCl
E. NaOH
Soal 9
Pada reaksi :
H2SO4 + HI H2S + I2 + H2O
H2S + I2 + H2O
1,5 mol asam sulfat dapat mengoksidasi ion hidrogen iodide sebanyak . . . . mol
A. 12
B. 9
C. 6
D. 3
E. 1,5
Soal 10
Dalam larutan basa, kalium permanganate bertindak sebagai zat pengoksidasi. Persamaan reaksinya dapat dituliskan sebagai berikut.
MnO4- + 2H2O + ne MnO2 + bOH-
MnO2 + bOH-
Harga a, n dan b berturut turut yang tepat untuk menyetarakan persamaan reaksi tersebut adalah . . . .
A. 2, 3 dan 4
B. 3, 2 dan 4
C. 3, 1 dan 5
D. 2, 2 dan 5
E. 1, 2 dan 5
Soal 11
Reaksi redoks berikut
Fe2+ + MnO4- Fe3+ + Mn2+
Fe3+ + Mn2+
Berlangsung dalam suasana asam. Setelah disetarakan, perbandingan mol yang benar adalah . . . .
a. 5MnO4- : Fe3+
b. 5Fe3+ : 4H2O
c. 8H+ : 2Fe3+
d. 5Fe2+ : 2Mn2+
e. Fe2+ : 5Mn2+
Soal 12
KMnO4 bereaksi dengan H2C2O4 dalam suasana asam menghasilkan CO2 dan MnSO4 sesuai rekasi :
aMnO4- + bH+ + cH2C2O4 dMn2+ + eH2O + fCO2
dMn2+ + eH2O + fCO2
Nilai a, c, e dan f berturut turut adalah . . . .
A. 2, 5, 4 dan 4
B. 2, 5, 6, dan 10
C. 2, 5, 8, dan 10
D. 4, 5, 6 dan 8
E. 4, 5, 8 dan 10
Soal 13
Aki mobil mepunyai elektroda Pb dan PbO2. Perubahan yang terjadi pada waktu aki bekerja adalah . . . .
A. Pb dan PbO2 menjadi PbO
B. Pb dan PbO2 menjadi PbSO4
C. Pb menjadi PbSO4, sedangkan PbO2 tetap
D. Pb menjadi Pb3O4 sedangkan PbO2 menjadi PbO
E. Pb menjadi PbO2, sedangkan PbO2 menjadi Pb3¬O4
Soal 14
Diketahui data potensial elektroda standar :
Ag+(aq) + e Ag(s) E0 = +0,80 Volt
Ag(s) E0 = +0,80 Volt
Zn2+(aq) + 2e Zn(s) E0 = - 0, 76 Volt
Zn(s) E0 = - 0, 76 Volt
In3+(aq) + 3e In(s) E0 = - 0,34 Volt
In(s) E0 = - 0,34 Volt
Mn2+(aq) + 2e Mn(s) E0 = - 1,03 Volt
Mn(s) E0 = - 1,03 Volt
Reaksi redoks dibawah ini yang berlangsung spontan adalah . . . .
A. Zn(s) + Mn2+(aq) Mn(s) + Zn2+(aq)
Mn(s) + Zn2+(aq)
B. 3Ag(s) + In3+(aq) In(s) + 3Ag+(aq)
In(s) + 3Ag+(aq)
C. 2In(s) + 3Mn2+(aq) 3Mn(s) + 2In3+(aq)
3Mn(s) + 2In3+(aq)
D. 3Zn(s) + 2In3+(aq) 3Zn2+(aq) + 2In(s)
3Zn2+(aq) + 2In(s)
E. 2Ag(s) + Mn2+(aq) Mn(s) + 2Ag+(aq)
Mn(s) + 2Ag+(aq)
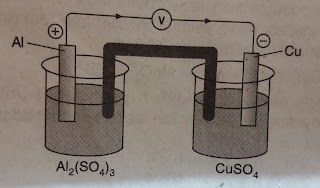
Soal 15
Suatu sel volta disusun seperti gambar berikut :
Diagram sel volta yang benar adalah . . . .
A. Al(s)|Al3+(aq) || Cu2+(aq)|Cu(s)
B. Al3+(aq)|Al(s) || Cu(s)|Cu2+(aq)
C. Cu2+(aq)| Cu(s) || Al(s) |Al3+(aq)
D. Cu(s)|Cu2+(aq)||Al3+(aq) |Al(s)
E. Al(s)|Cu2+(aq) ||Al3+(aq)|Cu(s)
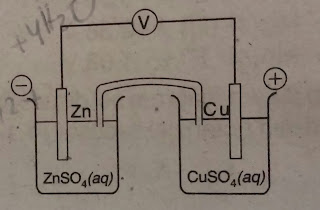
Soal 16
Penulisan diagram sel yang tepat dari diagram diatas adalah . . . .
A. Cu(s)|Cu2+(aq) || Zn(s)|Zn2+(aq)
B. Zn(s)|Zn2+(aq)||Cu2+(aq)|Cu(s)
C. Cu2+(aq)|Cu(s)||Zn2+(aq)|Zn(s)
D. Zn2+(aq)|Zn(s)||Cu(s)|Cu2+(aq)
E. Zn(s)|Zn2+(aq)|| Cu(s)|Cu2+(aq)
Soal 17
Pasangan elektroda yang digunakan pada aki timbal asam adalah . . . . .
Soal 18
Suatu sel volta terdiri atas elektroda Ag yang dicelupkan dalam larutan Ag+ 1M dan elektroda Zn dicelupkan ke dalam larutan Zn2+ 1 M. Diketahui :
Ag+(aq) + e Ag(s) E0 = +0,80 Volt
Ag(s) E0 = +0,80 Volt
Zn2+(aq) + 2e Zn(s) E0 = - 0,76 Volt
Zn(s) E0 = - 0,76 Volt
Pernyataan dibawah ini yang benar kecuali . . . .
A. Elektroda Zn bertindak sebagai anoda
B. Elektroda Ag bertindak sebagai katoda
C. Potensial standar selnya sebesar 2,36 Volt
D. Logam Ag mengendap pada electrode Ag
E. Reaksi selnya : 2Ag+(aq) + Zn(s) 2Ag(s) + Zn2+(aq)
2Ag(s) + Zn2+(aq)
Soal 19
Diketahui:
Pb2+|Pb = -0,13 V
Sn2+|Sn = -0,14 V
Mg2+|Mg = -2,37 V
Cu2+|Cu = +0,34V
Ni2+|Ni = -0,25 V
Fe3+|Fe = -0,44V
Berdasarkan harga E0 diatas, logam yang dapat memberikan perlindungan katodik pada besi adalah . . . .
A. Mg
B. Sn
C. Pb
D. Ni
E. Cu
Soal 20
Diketahui:
Br2(l) + 2e 2Br-(aq) E0 = +1,09 V
2Br-(aq) E0 = +1,09 V
I2(s) + 2e 2I-(aq) E0 = +0,54 V
2I-(aq) E0 = +0,54 V
F2(s) + 2e 2F-(aq) E0 = +2,87 V
2F-(aq) E0 = +2,87 V
Cl2(s) + 2e 2Cl-(aq) E0 = +1,36 V
2Cl-(aq) E0 = +1,36 V
Besar potensial sel untuk reaksi 2I-(aq) + F2(g) I2(s) + 2F-(aq) adalah . . . .Volt
I2(s) + 2F-(aq) adalah . . . .Volt
A. +2,33
B. +1,90
C. +1,51
D. +1,10
E. -1,51
Soal 21
Harga potensial sel Zn|Zn2+||Fe2+|Fe adalah. . . .(E0Zn2+ = -0,76 V dan E0 Fe2+ = -0,44 V)
A. -1,20 V
B. -0,32 V
C. -0,23 V
D. +0,32 V
E. +1,20 V
Soal 22
Diketahui:
Fe2+(aq) + 2e Fe(s) E0 = - 0,44 V
Fe(s) E0 = - 0,44 V
Cu2+(aq) + 2e Cu(s) E0 = +0,34 V
Cu(s) E0 = +0,34 V
Zn2+(aq) + 2e Zn(s) E0 = - 0,76 V
Zn(s) E0 = - 0,76 V
Ag+(aq) + e Ag(s) E0 = + 0,80 V
Ag(s) E0 = + 0,80 V
Mg2+(aq) + 2e Mg(s) E0 = - 2,38 V
Mg(s) E0 = - 2,38 V
Al3+(aq) + 3e Al(s) E0 = - 1,67 V
Al(s) E0 = - 1,67 V
Dari data diatas, logam yang paling mudah tereduksi adalah . . . .
A. Mg
B. Al
C. Ag
D. Cu
E. Zn
Soal 23
Persamaan rekasi yang berlangsun apabila seng dimasukkan ke dalam larutan besi(III)klorida adalah . . . .
A. 3Zn(s) + Fe3+(aq) 3Zn2+(aq) + Fe(s)
3Zn2+(aq) + Fe(s)
B. Zn(s) + 2Fe2+(aq) 3Zn2+(aq) + 2Fe3+(s)
3Zn2+(aq) + 2Fe3+(s)
C. Zn(s) + Fe3+(aq) Zn2+(aq) + Fe(s)
Zn2+(aq) + Fe(s)
D. 3Zn(s) + 2Fe2+(aq) 3Zn2+(aq) + 2Fe3+(aq)
3Zn2+(aq) + 2Fe3+(aq)
E. Zn(s) + 2Fe3+(aq) Zn2+(aq) + 2Fe2+(aq)
Zn2+(aq) + 2Fe2+(aq)
Soal 24
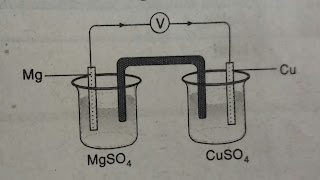
Perhatikan rangkaian sel volta berikut!
Berdasrakan gambar ragkaian tersebut, diagram sel yang tepat adalah . . . .
A. Mg2+|Mg||Cu|Cu2+
B. Mg2+|Mg||Cu2+|Cu
C. Mg|Mg2+|| Cu|Cu2+
D. Mg|Mg2+|| Cu2+|Cu
E. Cu2+|Cu || Mg|Mg2+
Soal 25
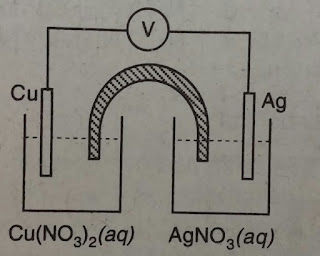
Perhatikan gambar berikut!
Diketahui reaksi setengah sel :
Ag+ + e Ag E0 = +0,80 V
Ag E0 = +0,80 V
Cu2+ + 2e Cu E0 = +0,34 V
Cu E0 = +0,34 V
Besar E0sel adalah . . . . V
A. +0,46
B. +0.63
C. +1,14
D. +1,26
E. +1,94.
Nah itulah tadi telah diuraikan mengenai Soal Pilihan Ganda tentang Reaksi Redoks. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
>
Loading...
Soal 1
A. Cl2 dan HClO4
B. HCl dan HClO2
C. ClO2 dan HClO3
D. Cl2 dan KClO3
E. Cl- dan NaClO4
Soal 2
Diketahui reaksi redoks berikut.
aCr2O72-(aq) + bH+(aq) + cCl-(aq)
Harga koefisien reaksi untuk a, b dan c berturut turut adalah . . . .
A. 1, 2 dan 4
B. 1, 2 dan 2
C. 1, 14 dan 2
D. 1, 14 dan 6
E. 2, 7 dan 6
Soal 3
Reaksi reaksi dibawah ini termasuk rekasi redoks kecuali . . . .
A. Zn + H2SO4
B. SO3 + H2O
C. Cl2 + 2NaOH
D. Cu + CuCl2
E. Cl2 + 2KBr
Soal 4
Diketahui rekasi redoks :
CuO + H2
Zat yang bertindak sebagai oksidator pada reaksi tersebut adalah . . . .
A. Cu
B. H2
C. Cu2+
D. H+
E. O2-
Soal 5
Pernyataan yang benar pada reaksi
Cr2O3 + KClO3 + KOH
Adalah . . . . .
A. KOH sebagai reduktor
B. Cr2O3 mengalami reduksi
C. KCl sebagai hasil reduksi
D. H2O sebagai hasil oksidasi
E. Bilangan oksidasi Cr dalam K2CrO4 adalah +7
Soal 6
Dalam ion H2P2O7-2 bilangan oksidasi P adalah . . . .
a. 2
b. 3
c. 4
d. 5
e. 6
Soal 7
Perubahan bilangan oksidasi unsur nitrogen pada reaksi :
CuS + NO3-
Adalah . . . .
A. Berkurang 3
B. Bertambah 3
C. Berkurang 2
D. Betambah 2
E. Bertambah 5
Soal 8
Gas klorin (Cl2) yang ditambahkan kedalam pengolahan air minum dan kolam renang bertujuan untuk membunuh bakteri. Reaksi pemebntukan gas klorin sebagai berikut :
2NaCl + 2H2O H2 + Cl2 + 2NaOH
Zat yang berperan sebagai reduktor adalah . . . .
A. Cl2
B. H2
C. H2O
D. NaCl
E. NaOH
Soal 9
Pada reaksi :
H2SO4 + HI
1,5 mol asam sulfat dapat mengoksidasi ion hidrogen iodide sebanyak . . . . mol
A. 12
B. 9
C. 6
D. 3
E. 1,5
Soal 10
Dalam larutan basa, kalium permanganate bertindak sebagai zat pengoksidasi. Persamaan reaksinya dapat dituliskan sebagai berikut.
MnO4- + 2H2O + ne
Harga a, n dan b berturut turut yang tepat untuk menyetarakan persamaan reaksi tersebut adalah . . . .
A. 2, 3 dan 4
B. 3, 2 dan 4
C. 3, 1 dan 5
D. 2, 2 dan 5
E. 1, 2 dan 5
Soal 11
Reaksi redoks berikut
Fe2+ + MnO4-
Berlangsung dalam suasana asam. Setelah disetarakan, perbandingan mol yang benar adalah . . . .
a. 5MnO4- : Fe3+
b. 5Fe3+ : 4H2O
c. 8H+ : 2Fe3+
d. 5Fe2+ : 2Mn2+
e. Fe2+ : 5Mn2+
Soal 12
KMnO4 bereaksi dengan H2C2O4 dalam suasana asam menghasilkan CO2 dan MnSO4 sesuai rekasi :
aMnO4- + bH+ + cH2C2O4
Nilai a, c, e dan f berturut turut adalah . . . .
A. 2, 5, 4 dan 4
B. 2, 5, 6, dan 10
C. 2, 5, 8, dan 10
D. 4, 5, 6 dan 8
E. 4, 5, 8 dan 10
Soal 13
Aki mobil mepunyai elektroda Pb dan PbO2. Perubahan yang terjadi pada waktu aki bekerja adalah . . . .
A. Pb dan PbO2 menjadi PbO
B. Pb dan PbO2 menjadi PbSO4
C. Pb menjadi PbSO4, sedangkan PbO2 tetap
D. Pb menjadi Pb3O4 sedangkan PbO2 menjadi PbO
E. Pb menjadi PbO2, sedangkan PbO2 menjadi Pb3¬O4
Soal 14
Diketahui data potensial elektroda standar :
Ag+(aq) + e
Zn2+(aq) + 2e
In3+(aq) + 3e
Mn2+(aq) + 2e
Reaksi redoks dibawah ini yang berlangsung spontan adalah . . . .
A. Zn(s) + Mn2+(aq)
B. 3Ag(s) + In3+(aq)
C. 2In(s) + 3Mn2+(aq)
D. 3Zn(s) + 2In3+(aq)
E. 2Ag(s) + Mn2+(aq)
Soal 15
Suatu sel volta disusun seperti gambar berikut :
Diagram sel volta yang benar adalah . . . .
A. Al(s)|Al3+(aq) || Cu2+(aq)|Cu(s)
B. Al3+(aq)|Al(s) || Cu(s)|Cu2+(aq)
C. Cu2+(aq)| Cu(s) || Al(s) |Al3+(aq)
D. Cu(s)|Cu2+(aq)||Al3+(aq) |Al(s)
E. Al(s)|Cu2+(aq) ||Al3+(aq)|Cu(s)
Soal 16
Penulisan diagram sel yang tepat dari diagram diatas adalah . . . .
A. Cu(s)|Cu2+(aq) || Zn(s)|Zn2+(aq)
B. Zn(s)|Zn2+(aq)||Cu2+(aq)|Cu(s)
C. Cu2+(aq)|Cu(s)||Zn2+(aq)|Zn(s)
D. Zn2+(aq)|Zn(s)||Cu(s)|Cu2+(aq)
E. Zn(s)|Zn2+(aq)|| Cu(s)|Cu2+(aq)
Soal 17
Pasangan elektroda yang digunakan pada aki timbal asam adalah . . . . .
Soal 18
Suatu sel volta terdiri atas elektroda Ag yang dicelupkan dalam larutan Ag+ 1M dan elektroda Zn dicelupkan ke dalam larutan Zn2+ 1 M. Diketahui :
Ag+(aq) + e
Zn2+(aq) + 2e
Pernyataan dibawah ini yang benar kecuali . . . .
A. Elektroda Zn bertindak sebagai anoda
B. Elektroda Ag bertindak sebagai katoda
C. Potensial standar selnya sebesar 2,36 Volt
D. Logam Ag mengendap pada electrode Ag
E. Reaksi selnya : 2Ag+(aq) + Zn(s)
Soal 19
Diketahui:
Pb2+|Pb = -0,13 V
Sn2+|Sn = -0,14 V
Mg2+|Mg = -2,37 V
Cu2+|Cu = +0,34V
Ni2+|Ni = -0,25 V
Fe3+|Fe = -0,44V
Berdasarkan harga E0 diatas, logam yang dapat memberikan perlindungan katodik pada besi adalah . . . .
A. Mg
B. Sn
C. Pb
D. Ni
E. Cu
Soal 20
Diketahui:
Br2(l) + 2e
I2(s) + 2e
F2(s) + 2e
Cl2(s) + 2e
Besar potensial sel untuk reaksi 2I-(aq) + F2(g)
A. +2,33
B. +1,90
C. +1,51
D. +1,10
E. -1,51
Soal 21
Harga potensial sel Zn|Zn2+||Fe2+|Fe adalah. . . .(E0Zn2+ = -0,76 V dan E0 Fe2+ = -0,44 V)
A. -1,20 V
B. -0,32 V
C. -0,23 V
D. +0,32 V
E. +1,20 V
Soal 22
Diketahui:
Fe2+(aq) + 2e
Cu2+(aq) + 2e
Zn2+(aq) + 2e
Ag+(aq) + e
Mg2+(aq) + 2e
Al3+(aq) + 3e
Dari data diatas, logam yang paling mudah tereduksi adalah . . . .
A. Mg
B. Al
C. Ag
D. Cu
E. Zn
Soal 23
Persamaan rekasi yang berlangsun apabila seng dimasukkan ke dalam larutan besi(III)klorida adalah . . . .
A. 3Zn(s) + Fe3+(aq)
B. Zn(s) + 2Fe2+(aq)
C. Zn(s) + Fe3+(aq)
D. 3Zn(s) + 2Fe2+(aq)
E. Zn(s) + 2Fe3+(aq)
Soal 24
Perhatikan rangkaian sel volta berikut!
Berdasrakan gambar ragkaian tersebut, diagram sel yang tepat adalah . . . .
A. Mg2+|Mg||Cu|Cu2+
B. Mg2+|Mg||Cu2+|Cu
C. Mg|Mg2+|| Cu|Cu2+
D. Mg|Mg2+|| Cu2+|Cu
E. Cu2+|Cu || Mg|Mg2+
Soal 25
Perhatikan gambar berikut!
Diketahui reaksi setengah sel :
Ag+ + e
Cu2+ + 2e
Besar E0sel adalah . . . . V
A. +0,46
B. +0.63
C. +1,14
D. +1,26
E. +1,94.
Nah itulah tadi telah diuraikan mengenai Soal Pilihan Ganda tentang Reaksi Redoks. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
Loading...