Selamat Datang kembali di blog freemathlearn. Blog yang membahas seputar matematika dan ilmu sains lainnya. Baiklah untuk kali ini akan kita bahas mengenai
Soal dan Pembahasan tentang Reaksi Reaksi Elektrolisis. Silakan disimak ya guys!
>
Nah itulah tadi telah diuraikan mengenai Soal dan Pembahasan tentang Reaksi Reaksi Elektrolisis. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
>
Loading...
Syarat utama kalian bisa membuat reaksi elektrolisis suatu senyawa adalah kalian harus menghafal aturan aturan reaksi yang terjadi dikatoda dan anoda.
Soal 1
Logam berikut yang hanya dapat dibuat dari elektrolisis leburan garamnya adalah. . . . .
A. Nikel
B. Perak
C. Natrium
D. Kromium
E. Tembaga
Pembahasan :
Soal ini berkaitan dengan aturan pertama reaksi yang terjadi di katoda.
Logam itu adalah atom yang cederung melepaskan electron membentuk ion bermuatan positif sehingga akan bereaksi di katoda.
Ingat!!
Kation = Ion positif = bereaksi di katoda = reduksi
Anion = Ion negative = bereaksi di anoda = oksidasi
Semua logam dalam larutannya (aq) akan bereaksi di katoda kecuali logam logam aktif yaitu logam golongan IA, IIA, Al3+ dan Mn2+ karena potensial reduksi logam ini jauh lebih lecil dibandingkan air sebagai pelarutnya sehingga airlah yang akan tereduksi.
Reaksi : 2H2O(l) + 2e  H2(g) + 2OH-(aq)
H2(g) + 2OH-(aq)
Logam logam golongan IA, IIA, Al3+ dan Mn2+ hanya bisa direduiksi jika dalam bentuk lelehan atau leburan karena tidak mengandung air.
Berdasarkan hal ini, maka logam pada option soal diatas yang hanya bisa dibuat dari elektrolisis leburan garamnya adalah natrium.
Jawaban : C
Soal 2
Zat yang dihasilkan dikatode pada elektrolisis larutan CaCl2 adalah . . . .
A. Gas klor
B. Gas hidrogen
C. Gas oksigen
D. Endapan Ca
E. Endapan CaCl2
Pembahasan :
Pertama buatlah rekasi penggionan terlebih dahulu….
CaCl2  Ca2+ + 2Cl-
Ca2+ + 2Cl-
Kation = Ca2+ = bereaksi dikatoda = mengalami reduksi
Anion = Cl- = bereaksi di anoda = mengalami oksidasi
Karena CaCl2 dalam bentuk larutan maka dikatoda aan ada persainagn antara air dan ion Ca2+ untuk mengalami reduksi. Siapa yang menang??. Berdasarkan aturan pertama Ca2+ adalah logam golongan IIA yang potensial reduksinya lebih kecil dibandingkan air, sehingga yang mengalami reduksi adalah air.
Reaksi : 2H2O(l) + 2e  H2(g) + 2OH-(aq)
H2(g) + 2OH-(aq)
Tampak dari reaksi diatas gas yang terbentuk adalah H2 (gas hidrogen)
Jawaban : C
Soal 3
Pada elektrolisis larutan Mg(NO3)2 dengan elektroda karbon, reaksi yang berlangsung dianode adalah . . . .
A. 2H2O(l) + 2e  H2(g) + 2OH-(aq)
H2(g) + 2OH-(aq)
B. 2H2O(l)  4H+(aq) + O2(g) + 4e
4H+(aq) + O2(g) + 4e
C. H2(g) + 2OH-(aq)  2H2O(l) + 2e
2H2O(l) + 2e
D. 4H+(aq) + O2(g) + 4e  2H2O(l)
2H2O(l)
E. 4OH-(aq)  2H2O(l) + O2(g) + e
2H2O(l) + O2(g) + e
Pembahasan :
Reaksi pengionan :
Mg(NO¬3)2  Mg2+ + 2NO3-
Mg2+ + 2NO3-
Anion = NO3- = terokdisasi di anoda
Elektroda yang digunakan adalah karbon yang tergolongan elektroda inert (tidak ikut bereaksi)
Aturan pertama di anoda sesuai soal :
Jika elektrodanya selain elektroda inert ( Karbon= grafit, Emas(Au) dan Platina(Pt)) maka elektroda itu yang akan teroksidasi di anoda.
Contoh :
Misalkan dalam suatu elektrolisis digunakan elektroda tembaga (Cu). Karena tembaga bukan elektroda inert maka tembagalah yang akan bereaksi di anoda.
Reaksi : Cu2+ + 2e Cu
Karena pada soal yang digunakan elektroda inert, maka anionnya yang akan berekasi di anoda.
Aturan kedua sesuai dengan soal (untuk aturan lengkap silahkan kalian lihat literatur masing masing ):
Jika anionnya adalah anion sisa asam yang beroksigen (seperti SO42-, NO3-, PO43- dan CO32-) maka yang teroksidasi adalah air.
Pada soal diatas anionnya adalah NO3- yang merupakan anion sisa asam beroksigen, maka yang teroksidasi di anoda adalah air dengan reaksi :
2H2O(l)  4H+(aq) + O2(g) + 4e
4H+(aq) + O2(g) + 4e
Jawaban : B
Soal 4
Elektrolisis larutan atau lelehan berikut yang dapat menghasilkan gas hidrogen di katode dan gas oksigen di anode adalah . . . .
A. AgNO3(aq)
B. Na2SO4 (aq)
C. NaCl(l)
D. MgCl2(aq)
E. KI(aq)
Pembahasan :
Gas hidrogen akan dihasilkan dikatode jika :
- Dalam bentuk larutan kationnya adalah logam golongan IA, IIA, Al dan Mn. Karena yang akan tereduksi adalah air. Reaksinya : 2H2O(l) + 2e
H2(g) + 2OH-(aq)
- Kationnya adalah H+, yang akan tereduksi mengasilkan gas hidrogen. Reaksinya : 2H+(aq) + 2e
H2(g)
Gas oksigen akan dihasilkan di anode jika :
- Jika anionnya adalah ion sisa asam beroksigen yaitu SO42-, NO3-, PO43- dan CO32- karena yang teroksidasi adalah air . Reaksinya : 2H2O(l)
4H+(aq) + O2(g) + 4e
- Anionnya adalah O2- yang akan teroksidasi menghasilkan gas oksigen. Reaksi : 2O2-(aq)
O2(g) + 4e
AgNO3  Ag+ + NO3-
Ag+ + NO3-
Katoda : Ag+ + e  Ag
Ag
Anoda : 2H2O(l)  4H+(aq) + O2(g) + 4e
4H+(aq) + O2(g) + 4e
Na2SO4(aq)  2Na+ + SO42-
2Na+ + SO42-
Katoda : 2H2O(l) + 2e  H2(g) + 2OH-(aq)
H2(g) + 2OH-(aq)
Anoda : 2H2O(l)  4H+(aq) + O2(g) + 4e
4H+(aq) + O2(g) + 4e
NaCl(l)  Na+ + Cl-
Na+ + Cl-
Katoda : Na+ + e  Na
Na
Anoda : 2Cl-  Cl2 + 2e
Cl2 + 2e
MgCl2(aq)  Mg2+ + 2Cl-
Mg2+ + 2Cl-
Katoda : 2H2O(l) + 2e  H2(g) + 2OH-(aq)
H2(g) + 2OH-(aq)
Anoda : 2Cl-  Cl2 + 2e
Cl2 + 2e
KI(aq)  K+(aq) + I-(aq)
K+(aq) + I-(aq)
Katoda : 2H2O(l) + 2e  H2(g) + 2OH-(aq)
H2(g) + 2OH-(aq)
Anoda : 2I-  I2 + 2e
I2 + 2e
Berdasarkan reaksi diatas zat yang menghasilkan gas hidrogen dikatoda dan gas oksigen dinaoda adalah Na2SO4
Jawaban : B
Soal 5
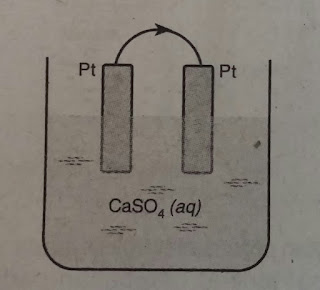
Berdasarkan gambar diatas, zat yang dihasilkan dianode dan karode adalah . . . .
A. Gas H2 di katode dan gas O2 di anode
B. Gas O2 di katode dan gas H2 di anode
C. Endapan Pt di katoda dan gas O2 di naode
D. Endapan Ca di katoda dan gas O2 di anode
E. Endapan Ca di katode dan gas H2 di anode.
Pembahasan :
Saya ajarkan satu trik bagaimana mengeleminasi jawaban yang sebenarnya tidak mungkin benar.
Yang perlu kalian ingat!!
- Gas hidrogen hanya akan dihasilkan di katode
- Gas hidrogen hanya akan dihasilkan di anode
- Elektroda baik inert maupun tidak inert tidak akan pernah berekasi di katode
- Logam golongan IA, IIA, Al dan Mn jika dalam bentuk larutan tidak akan pernah mengendap di katode
Tapi karena kita masih berlatih, tidak ada salahnya kita buat reaksi yang terjadi dikatode dan anode jika CaSO4 dielektrolisis dengan elektroda Pt.
Pt = elektroda inert = tidak berekasi di anoda
Reaksi penggionan :
CaSO4(aq)  Ca2+ + SO42-
Ca2+ + SO42-
Kation = Ca2+ = ion logam golongan IIA = tereduksi adalah air
Anion = SO42- = ion sisa asam beroksigen = yang teroksidasi adalah air
Reaksi elektrolisisnya :
Katoda : 2H2O(l) + 2e  H2(g) + 2OH-(aq)
H2(g) + 2OH-(aq)
Anoda : 2H2O(l)  4H+(aq) + O2(g) + 4e
4H+(aq) + O2(g) + 4e
Jadi gas hidrogen dihasilkan di katode dan gas oksigen dihasilkan di anode.
Jawaban : A
Soal 6
Pada reaksi elektrolisis larutan NiSO4 dengan elektroda Ag, reaksi yang terjadi di anode adalah . . . .
A. Ni2+ (aq)  2e- + Ni(s)
2e- + Ni(s)
B. Ag(s)  Ag+(aq) + e
Ag+(aq) + e
C. Ni(s)  Ni2+(aq) + 2e
Ni2+(aq) + 2e
D. 2H2O(l) + 2e  H2(g) + 2OH-(aq)
H2(g) + 2OH-(aq)
E. 2H2O(l)  4H+(aq) + O2(aq) + 4e
4H+(aq) + O2(aq) + 4e
Pembahasan :
Ingat!!
Anode = tempat terjadinya reaksi oksidasi= Ciri cirinya adalah elektronnya ada pada produk (sebelah kanan)
Jadi jawaban option D pasti salah, karena rekasinya adalah reduksi.
Selalu diperhatikan bahwa jika akan menulis reaksi di anode kalian lihat dulu elektroda yang digunakan. Jika tidak inner maka elektrodanya yang akan bereaksi.
Pada soal diatas, elektroda yang digunakan adalag Ag yang merupakan elektroda tidak inert , maka elektrodanya yang akan teroksidasi.
Reaksi : Ag  Ag+ + e
Ag+ + e
Jawaban : B
Soal 7
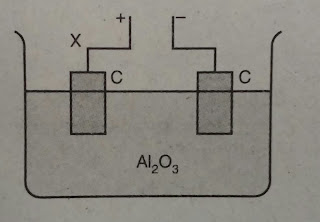
Lelehan Al2O3 dielektrolisis dengan elektroda grafit. Rangkaiannya seperti gambar berikut.
Reaksi yang terjadi di X adalah . . . . .
A. 2O2-(l)  O2(g) + 4e
O2(g) + 4e
B. Al3+(l) + 3e  Al(s)
Al(s)
C. 2H2O(l)  4H+(aq) + 4e + O2(g)
4H+(aq) + 4e + O2(g)
D. 4OH-(aq)  2H2O(l) + 4e + O2(g)
2H2O(l) + 4e + O2(g)
E. 2H2O(l) + 2e  2OH-(aq) + H2(g)
2OH-(aq) + H2(g)
Pembahasan :
Zat yang dielektrolisis : Al2¬O3
Reaksi penggionan : Al2¬O3 2Al3+ + 3O2-
Elektroda yang digunakan : C (Elektroda inert)
Ingat!!
Pada sel elektrolisis = Katoda adalah kutub negative sedangkan anode adalah kutub positif. Biasanya disinggkat KNAPE ( Katoda Negatif Anoda Positif Elektroisis)
Tanda X pada gambar diatas, menunjukkan kutub postif. Hal ini berarti X adalah reaksi yang terjadi di anoda = reaksi oksidasi.
Ingat!!
Reaksi oksidasi = elektronnya ada di sebelah kanan (produk)
Jadi option B dan E pasti salah.
Anion dari Al2O3 adalah O2-. Maka reaksi oksdidasinya adalah : 2O2-(l)  O2(g) + 4e
O2(g) + 4e
Jawaban : A
.
Nah itulah tadi telah diuraikan mengenai Soal dan Pembahasan tentang Reaksi Reaksi Elektrolisis. Bagaimana, silakan berkomentar atau kritik, saran ataupun tambahan dari kamu. Kita tahu kita bukan yang sempurna, siapa tahu kamu lebih dan bisa berbagi. Ditunggu komentarnya guys.
Loading...